
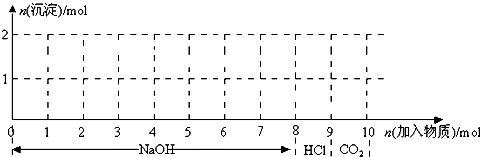
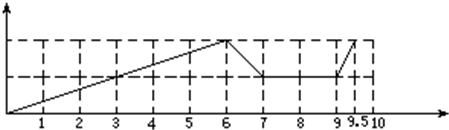

 ,
, ;
;

 文敬圖書課時先鋒系列答案
文敬圖書課時先鋒系列答案科目:高中化學 來源: 題型:

| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 .
.
| 3b |
| 4 |
| 3b |
| 4 |
| 實驗步驟 | 操作 | 現象與結論 |
| 第一步 | 取少量液體裝于試管,向試管中滴入幾滴KSCN溶液 | |
| 第二步 | 若溶液紫色退去,則說明含有Fe2+, 若無明顯變化,則說明不含Fe2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 殘留固體成分 | Fe、Cu | Cu | Cu | - | - | - |
| 溶液中的金屬離子 |
| 8 |
| 3 |
| x |
| 3 |
| 8 |
| 3 |
| x |
| 3 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| 反應條件 | 主要產物 | 生成1mol有機物 △H/kJ?mol-1 |
| Cu-ZnO-Cr2O3-MnO,200~400℃,30~40MPa | 甲醇 | -128 |
| Ni,250~500℃,常壓 | 甲烷(和水蒸氣) | -206.2 |
| FeO-Co-Ni,150~350℃,0.1~3MPa | 人造石油 | |
| Ru,150~250℃,10~100MPa | 固態烷烴 | |
| ThO-ZnO-Al2O3,400~500℃,10~100MPa | 異丁烷、異戊烷 | |
| Co-Fe,100~200℃,10~20MPa | 含氧有機化合物 | |
| Rh原子簇配合物,高壓液相 | 乙二醇 (少量乙酸、乙醇) |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com