
| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物煉銅的原理是利用某些具有特殊本領的細菌把不溶性的硫化銅轉化為銅單質 | |
| C. | 霾是懸浮在大氣中的大量微小塵粒、煙粒或鹽粒的集合體,霾的形成與PM2.5有直接關系 | |
| D. | 一些有機溶劑(如乙醚、乙醇、苯、丙酮等)沸點低且極易被引燃,加熱時最好用水浴加熱 |
分析 A.相對分子質量在10000以上的有機化合物為高分子化合物,高分子化合物分為天然高分子化合物、合成高分子化合物;
B.微生物法是采用某些細菌能用空氣中的氧氣氧化硫化銅礦石;
C.霾是懸浮在大氣中的大量微小塵粒、煙粒或鹽粒的集合體;
D.沸點低加熱易燃燒,水浴加熱的溫度較低.
解答 解:A.蛋白質、棉花、淀粉都相對分子質量在10000以上,屬于天然高分子化合物,故A正確;
B.把不溶性的硫化銅氧化,硫從負二價被氧化成正六價,故最后轉化成可溶的硫酸銅,故B錯誤;
C.霾是由懸浮在大氣中的大量微小塵粒、煙粒等直徑小于2.5μm的顆粒物形成的,這些污染物稱為PM2.5,故C正確;
D.水浴加熱的溫度較低,則一些有機溶劑(如乙醚、乙醇、苯、丙酮等)沸點低極易被引燃,加熱時最好用水浴加熱,故D正確.
故選B.
點評 本題考查化學與環境、材料、信息、能源關系密切相關的知識,為高頻考點,側重于基礎知識的綜合理解和運用的考查,難度不大.


 全優點練單元計劃系列答案
全優點練單元計劃系列答案科目:高中化學 來源: 題型:解答題
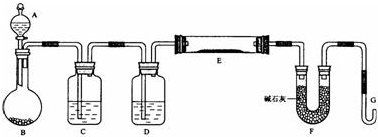
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
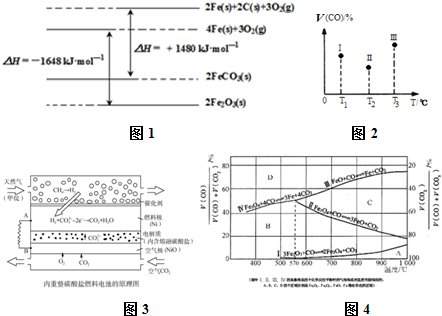
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
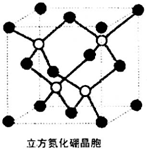 H2O和CS2分子中的原子都達到穩定結構.
H2O和CS2分子中的原子都達到穩定結構.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
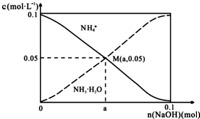 常溫下,向1L0.1mol•L-1NH4Cl溶液中,不斷加入固體NaOH后,NH4+與NH3•H2O的變化趨勢如圖所示(不考慮體積變化和氨的揮發),下列說法正確的是( )
常溫下,向1L0.1mol•L-1NH4Cl溶液中,不斷加入固體NaOH后,NH4+與NH3•H2O的變化趨勢如圖所示(不考慮體積變化和氨的揮發),下列說法正確的是( )| A. | M點溶液中水的電離程度比原溶液大 | |
| B. | 在M點時,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 隨著NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不斷增大 | |
| D. | 當n(NaOH)=0.05mol時溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
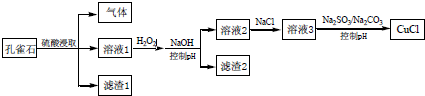
| A. | H2O2 將溶液1 中Fe2+氧化為Fe3+,再通過控制pH 轉化為Fe(OH)3除去 | |
| B. | CO32-作用是控制溶液pH,促使CuCl 沉淀的生成 | |
| C. | SO32-將溶液3 中的Cu2+還原,反應得到CuCl | |
| D. | 若改變試劑加入順序,將溶液3緩慢加入到含大量$\frac{S{O}_{3}^{2-}}{C{O}_{3}^{2-}}$的溶液中,同樣可制取CuCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由反應SiO2+4HF═SiF4+2H2O,可知SiO2是堿性氧化物 | |
| B. | 由酸性溶液中MnO4-可以氧化Cl-,可知酸性溶液中MnO4-也能氧化Br- | |
| C. | 由反應CuSO4+H2S═CuS+H2SO4,可知酸性H2S>H2S04 | |
| D. | 由常溫下金屬鈉、鋁可溶于NaOH溶液,可知金屬鎂也能溶于NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用電池外殼的金屬材料 | |
| B. | 防止電池中汞、鎘和鉛等重金屬離子對土壤和水源的污染 | |
| C. | 不使電池中滲泄的電解液腐蝕其他物品 | |
| D. | 回收其中石墨電極 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 容器編號 | 溫度(℃) | 起始物質的量(mol) | 平衡物質的量(mol) | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com