
還原沉淀法是處理含鉻(含Cr2O72﹣和CrO42﹣)工業廢水的常用方法,過程如下:

己知轉化過程中反應為:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。轉化后所得溶液中鉻元素含量為28.6g/L,CrO42﹣有10/11轉化為Cr2O72﹣。下列說法不正確的是
Cr2O72﹣(aq)+H2O(1)。轉化后所得溶液中鉻元素含量為28.6g/L,CrO42﹣有10/11轉化為Cr2O72﹣。下列說法不正確的是
A.溶液顏色保持不變,說明上述可逆反應達到達平衡狀態
B.若用綠礬(FeSO4·7H2O)(M=278)作還原劑,處理1L廢水,至少需要917.4g
C.常溫下轉化反應的平衡常數K=1×1014,則轉化后所得溶液的pH=6
D.常溫下Ksp[Cr(OH)3]=1×10﹣32,要使處理后廢水中c(Cr3+)降至1×10﹣5mol/L,應調溶液的pH=5
B
【解析】
試題分析:A.CrO42﹣為黃色的,Cr2O72﹣為橙色的,如果2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)未達到平衡,正向進行,則橙色加深,如果逆向進行則黃色加深。現在溶液顏色保持不變,說明上述可逆反應達到達平衡狀態。正確。B. 在1L廢水中+6價的Cr的物質的量為n(Cr)= 28.6g÷ 52g/mol =0.55mol .根據氧化還原反應中電子得失數目相等可得。n(FeSO4·7H2O)=3×0.55mol=1.65mol。m(FeSO4·7H2O) = 1.65mol×278g/mol=458.7g.錯誤。守恒可得0.55mol C. 2CrO42﹣(aq)+2H+(aq)
Cr2O72﹣(aq)+H2O(1)未達到平衡,正向進行,則橙色加深,如果逆向進行則黃色加深。現在溶液顏色保持不變,說明上述可逆反應達到達平衡狀態。正確。B. 在1L廢水中+6價的Cr的物質的量為n(Cr)= 28.6g÷ 52g/mol =0.55mol .根據氧化還原反應中電子得失數目相等可得。n(FeSO4·7H2O)=3×0.55mol=1.65mol。m(FeSO4·7H2O) = 1.65mol×278g/mol=458.7g.錯誤。守恒可得0.55mol C. 2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)的平衡常數為
Cr2O72﹣(aq)+H2O(1)的平衡常數為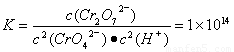 c(CrO42-)={(28.6÷52)÷11}mol/L=0.05mol/L, c(Cr2O72-)=(11÷2)×c(CrO42-)=0.25mol/L,代入該平衡常數表達式中可得c(H+)=10-6mol/L.所以pH=6.正確。D. c(Cr3+)·c3(OH-)=1×10﹣32. c3(OH-)=1×10﹣32÷1×10﹣5=1×10﹣27.所以c(OH-)=1×10﹣9.c(H+)=1×10﹣14÷1×10﹣9=1×10﹣5. pH=5.正確.
c(CrO42-)={(28.6÷52)÷11}mol/L=0.05mol/L, c(Cr2O72-)=(11÷2)×c(CrO42-)=0.25mol/L,代入該平衡常數表達式中可得c(H+)=10-6mol/L.所以pH=6.正確。D. c(Cr3+)·c3(OH-)=1×10﹣32. c3(OH-)=1×10﹣32÷1×10﹣5=1×10﹣27.所以c(OH-)=1×10﹣9.c(H+)=1×10﹣14÷1×10﹣9=1×10﹣5. pH=5.正確.
考點:考查還原沉淀法是處理含鉻工業廢水的化學反應原理的知識。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
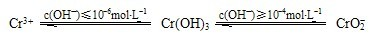
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(16分)I、(1)三種弱酸HA、H2B、HC,電離平衡常數的數值為1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(數據順序已打亂),已知三種酸和它們的鹽之間能發生以下反應:①HA+ HB- (少量)=A_ + H2B ,②H2B(少量) + C- = HB_+ HC ,③HA(少量) + C- =A_+ HC 。則三種酸對應的電離平衡常數分別為(請填空)
|
| HA | H2B | HC | |
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 數值 |
|
|
|
|
(2)常溫下0.1mol/LCH3COOH溶液加水稀釋過程,下列表達式數據一定變小是:_______
A c(H+) B c(H+)/c(CH3COOH) C c(H+)·c(OH-)
D c(OH-)/(H+)體積為10mLpH=2醋酸溶液與一元酸HX分別加水稀釋至1000mL,稀釋過程pH變化如圖:則HX電離平衡常數_____(填大于、等于或小于)醋酸平衡常數;理由是___________________________
II、工業廢水中常含有一定量的Cr2O72-和CrO42-,它們會對人體及生態系統產生很大的傷害,必須進行處理。還原沉淀法是常用的一種方法。
(1)轉化過程中存在平衡2CrO42- + 2H+ Cr2O72- +H2O能說明反應到達平衡狀態的是
A.CrO42- 和Cr2O72-的濃度相同 B.2ν(Cr2O72-)=ν(CrO42-)
C.溶液的pH值保持不變 D.溶液顏色保持不變
(2)若1L轉化后所得溶液中含鉻元素質量為28.6g,CrO42-有10/11轉化為Cr2O72-(已知鉻元素相對原子質量為52)。①轉化后所得溶液中c(Cr2O72-)=
②已知:常溫下該反應的平衡常數K=1014,上述轉化后所得溶液的pH為
(3)還原過程中的離子反應方程式
(4)若常溫下Ksp(Cr(OH)3)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH應調至
查看答案和解析>>
科目:高中化學 來源:2012屆河北省冀州市中學高三聯排考試化學試卷(帶解析) 題型:填空題
(16分)I、(1)三種弱酸HA、H2B、HC,電離平衡常數的數值為1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(數據順序已打亂),已知三種酸和它們的鹽之間能發生以下反應:①HA + HB- (少量)=A_ + H2B ,②H2B(少量) + C- = HB_ + HC ,③HA(少量) + C- =A_ + HC 。則三種酸對應的電離平衡常數分別為(請填空)
| | HA | H2B | HC | |
| Ka | Ka1 | Ka2 | Ka3 | Ka4 |
| 數值 | | | | |


 Cr2O72- + H2O能說明反應到達平衡狀態的是
Cr2O72- + H2O能說明反應到達平衡狀態的是查看答案和解析>>
科目:高中化學 來源:2011-2012學年河北省冀州市高三聯排考試化學試卷(解析版) 題型:填空題
(16分)I、(1)三種弱酸HA、H2B、HC,電離平衡常數的數值為1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(數據順序已打亂),已知三種酸和它們的鹽之間能發生以下反應:①HA + HB- (少量)=A_ + H2B ,②H2B(少量) + C- = HB_ + HC ,③HA(少量) + C- =A_ + HC 。則三種酸對應的電離平衡常數分別為(請填空)
|
|
HA |
H2B |
HC |
|
|
Ka |
Ka1 |
Ka2 |
Ka3 |
Ka4 |
|
數值 |
|
|
|
|
(2)常溫下0.1mol/LCH3COOH溶液加水稀釋過程,下列表達式數據一定變小是:_______
A c(H+) B c(H+)/c(CH3COOH) C c(H+)·c(OH-)
D c(OH-)/(H+)體積為10mLpH=2醋酸溶液與一元酸HX分別加水稀釋至1000mL,稀釋過程pH變化如圖:則HX電離平衡常數_____(填大于、等于或小于)醋酸平衡常數;理由是___________________________

II、工業廢水中常含有一定量的Cr2O72-和CrO42-,它們會對人體及生態系統產生很大的傷害,必須進行處理。還原沉淀法是常用的一種方法。

(1)轉化過程中存在平衡2CrO42- + 2H+  Cr2O72- +
H2O能說明反應到達平衡狀態的是
Cr2O72- +
H2O能說明反應到達平衡狀態的是
A.CrO42- 和Cr2O72-的濃度相同 B.2ν(Cr2O72-)=ν(CrO42-)
C.溶液的pH值保持不變 D.溶液顏色保持不變
(2)若1L轉化后所得溶液中含鉻元素質量為28.6g,CrO42-有10/11轉化為Cr2O72-(已知鉻元素相對原子質量為52)。①轉化后所得溶液中c(Cr2O72-)=
②已知:常溫下該反應的平衡常數K=1014,上述轉化后所得溶液的pH為
(3)還原過程中的離子反應方程式
(4)若常溫下Ksp(Cr(OH)3)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH應調至
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com