
(14分)圖a是1 mol NO2和1 mol CO反應生成CO2和NO過程中能量變化示意圖,圖b是反應中的CO和NO的濃度隨時間變化的示意圖。根據題意回答下列問題
(1)寫出NO2和CO反應的熱化學方程式 。
(2)從反應開始到平衡,用NO2濃度變化表示平均反應速率v(NO2)= 。
(3)此溫度下該反應的平衡常數K= ;溫度降低,K (填“變大”、“變小”或“不變”)
(4)若在溫度和容積相同的三個密閉容器中,按不同方式投入反應物,測得反應達到平衡吋的有關數據如下表:
| 容 器 | 甲 | 乙 | 丙 |
| 反應物投入量 | 1 mol NO2 1 mol CO | 2 mol NO 2 mol CO2 | 1 mol NO2、1 mol CO 1 mol NO、1 mol CO2 |
| 平衡時c(NO) /mol·L-1 | 1.5 | 3 | m |
| 能量變化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的轉化率 | α1 | α2 | α3 |
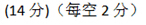

(3) 9 ; 變大
(4) 1 ; 234 ; 3
解析試題分析:(1)根據能量變化圖,反應熱等于生成物的總能量減去反應物的總能量,反應物和生成物能量的差值為E2-E1,寫出化學方程式,標出各物質的狀態,從而寫出熱化學方程式;(2)由圖可知,t1min到達平衡,平衡時NO的濃度變化量為1.5mol/L,根據v=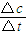 計算v(NO),再利用速率之比等于化學計量數之比計算v(NO2);(3)開始加入的CO和NO的物質的量相等,根據CO的起始濃度2mol/L確定NO2的起始濃度也為2mol/L,達到平衡時CO的濃度為0.5mol/L,故NO2的濃度也為0.5mol/L,根據方程式計算出NO和CO2的濃度均為1.5mol/L,代入平衡常數表達式計算出化學平衡常數;該反應為放熱反應,降低溫度,平衡向右移動,化學平衡常數增大;(4)甲與乙是等效平衡,對應各組分的含量完全相同,對應各組分的物質的量乙是甲中的2倍,CO的轉化率為α1,則平衡時CO的物質的量為(1-α1)mol,乙中平衡時NO的轉化率為α2,乙中平衡時CO的物質的量為2α2mol,故2(1-α1)=2α2,整理得α1+α2=1; 令平衡時甲中CO為nmol,則乙中CO為2nmol,甲中放出的熱量為(1-n)×234kJ=akJ乙中吸收的熱量為2n×234kJ=bkJ,整理得a+
計算v(NO),再利用速率之比等于化學計量數之比計算v(NO2);(3)開始加入的CO和NO的物質的量相等,根據CO的起始濃度2mol/L確定NO2的起始濃度也為2mol/L,達到平衡時CO的濃度為0.5mol/L,故NO2的濃度也為0.5mol/L,根據方程式計算出NO和CO2的濃度均為1.5mol/L,代入平衡常數表達式計算出化學平衡常數;該反應為放熱反應,降低溫度,平衡向右移動,化學平衡常數增大;(4)甲與乙是等效平衡,對應各組分的含量完全相同,對應各組分的物質的量乙是甲中的2倍,CO的轉化率為α1,則平衡時CO的物質的量為(1-α1)mol,乙中平衡時NO的轉化率為α2,乙中平衡時CO的物質的量為2α2mol,故2(1-α1)=2α2,整理得α1+α2=1; 令平衡時甲中CO為nmol,則乙中CO為2nmol,甲中放出的熱量為(1-n)×234kJ=akJ乙中吸收的熱量為2n×234kJ=bkJ,整理得a+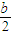 =234;丙與乙是完全等效平衡,平衡時NO的濃度相等,故m=3mol/L,
=234;丙與乙是完全等效平衡,平衡時NO的濃度相等,故m=3mol/L,
考點:熱化學方程式的書寫、化學平衡常數的計算、化學平衡的移動、等效平衡等知識。


科目:高中化學 來源: 題型:單選題
下列各組中的兩種物質作用,反應條件(溫度或者反應物用量)改變,不會引起產物種類改變的是( )
| A.Na和O2 | B.NaOH和CO2 |
| C.Na2O2和CO2 | D.AlCl3和NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(16分) 碳及其化合物有廣泛的用途。
(1)反應C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,達到平衡后,體積不變時,以下有利于提高H2產率的措施是 。
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,達到平衡后,體積不變時,以下有利于提高H2產率的措施是 。
| A.增加碳的用量 | B.升高溫度 | C.用CO吸收劑除去CO | D.加入催化劑 |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 CO2(g)+H2(g) 的△H= kJ?mol-1。
CO2(g)+H2(g) 的△H= kJ?mol-1。 CO2(g)+H2(g),得到如下數據:
CO2(g)+H2(g),得到如下數據:| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
催化劑是化工技術的核心,絕大多數的化工生產均需采用催化工藝。
(1)人們常用催化劑來選擇反應進行的方向。下左圖所示為一定條件下1mol CH3OH與O2發生反應時,生成CO、CO2或HCHO的能量變化圖[反應物O2(g)和生成物H2O(g)略去]。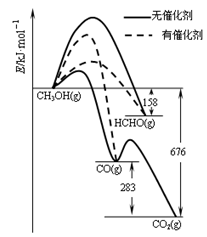
①在有催化劑作用下,CH3OH與O2 反應主要生成 (填“CO、CO2、HCHO”);
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H= 。
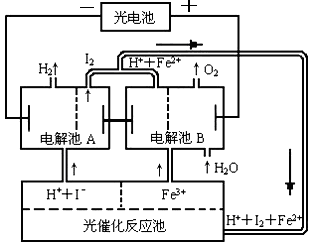
(2)一種以銅作催化劑脫硫有如下兩個過程:
①在銅的作用下完成工業尾氣中SO2的部分催化氧化,所發生反應為:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
從環境保護的角度看,催化脫硫的意義為 ;每吸收標準狀況下11.2L SO2,被SO2還原的O2的質量為 g。
②利用下圖所示電化學裝置吸收另一部分SO2,并完成Cu的再生。寫出裝置內所發生反應的離子方程式 。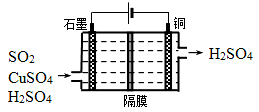
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(3分)以下反應:①木炭與水制備水煤氣 ②氯酸鉀分解 ③炸藥爆炸 ④酸與堿的中和反應 ⑤生石灰與水作用制熟石灰 ⑥ Ba(OH)2·8H2O與NH4Cl ⑦氣態水液化,屬于放熱反應的是
(填序號),寫出反應⑥的化學方程式__ ____。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14 分) 一氧化碳被廣泛應用于冶金工業和電子工業。
⑴高爐煉鐵是最為普遍的煉鐵方法,相關反應的熱化學方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H="a" kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H="b" kJ·mol-1
反應3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代數式表示)。
⑵電子工業中使用的一氧化碳常以甲醇為原料通過脫氫、分解兩步反應得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反應的機理可以用下圖表示: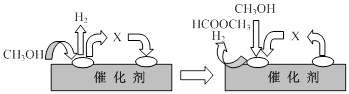
圖中中間產物X的結構簡式為 。
②在工業生產中,為提高CO的產率,可采取的合理措施有 。
⑶為進行相關研究,用CO還原高鋁鐵礦石,反應后固體物質的X—射線衍射譜圖如圖所示(X—射線衍射可用于判斷某晶態物質是否存在,不同晶態物質出現衍射峰的衍射角不同)。反應后混合物中的一種產物能與鹽酸反應生產兩種鹽,該反應的離子方程式為 。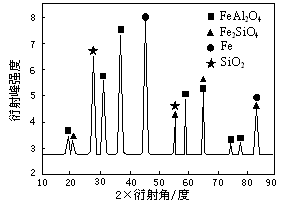
⑷某催化劑樣品(含Ni2O340%,其余為SiO2)通過還原、提純兩步獲得鎳單質:首先用CO將33.2 g樣品在加熱條件下還原為粗鎳;然后在常溫下使粗鎳中的Ni與CO結合成Ni(CO)4(沸點43 ℃),并在180 ℃時使Ni(CO)4重新分解產生鎳單質。
上述兩步中消耗CO的物質的量之比為 。
⑸為安全起見,工業生產中需對空氣中的CO進行監測。
①粉紅色的PdCl2溶液可以檢驗空氣中少量的CO。若空氣中含CO,則溶液中會產生黑色的Pd沉淀。每生成5.3gPd沉淀,反應轉移電子數為 。
②使用電化學一氧化碳氣體傳感器定量檢測空氣中CO含量,其結構如圖所示。這種傳感器利用原電池原理,則該電池的負極反應式為 。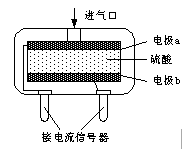
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分)如右圖所示,常溫下電解5 min后,銅電極質量增加2.16g。
試回答: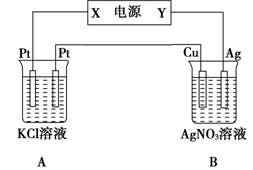
(1)電源電極X名稱為_______(填“正極”或“負極”)。
(2)電解池B中陰極的電極反應式是__________。
(3)若A中KCl溶液的體積是200mL,電解后溶液的
pH=_________(忽略電解前后溶液體積的變化)。
若要使電解后的溶液恢復到與電解完完全相同,應加入的物質是__________。
(4)已知在l0lkPa時,CO的燃燒熱為283 kJ/mol。相同條件下,若2 molCH4完全燃燒生成液態水,所放出的熱量為1 mol CO完全燃燒放出熱量的6.30倍,則CH4完全燃燒的熱化學方程式為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(16分)汽車尾氣中的CO、NOX已經成為大氣的主要污染物,使用稀土等催化劑能將CO、NOX、碳氫化合物轉化成無毒物質,從而減少汽車尾氣污染。
(1)已知:N2(g)+O2(g)=2NO(g) △H1 ①
2C(s)+O2(g)=2CO(g) △H2 ②
C(s)+O2(g)=CO2(g) △H3 ③
寫出NO與CO催化轉化成N2和CO2的熱化學方程式(反應熱用△H1、△H2、△H3表示): 。
(2)在容積相同的兩個密閉容器內(裝有等量的某種催化劑),分別充入同量的NOx及C3H6,在不同溫度下,同時發生以下反應:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g);
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
9N2(g)+12CO2(g)+12H2O(g);
并分別在t秒時測定其中NOX的轉化率,繪得圖像如下圖所示: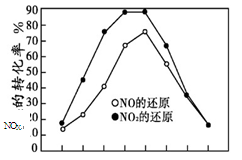
① 從圖中可以得出的結論是
結論一:相同溫度下, 。
結論二: 。
② 上述NO2和C3H6反應達平衡后,可提高NO2
轉化率的措施有 。(填編號)
| A.加入催化劑 | B.降低溫度 |
| C.分離出H2O(g) | D.增大壓強 |
 O2+Hb·CO K=220
O2+Hb·CO K=220查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Ⅰ.通常人們把拆開1 mol某化學鍵所吸收的能量看成該化學鍵的鍵能。下表為一些化學鍵的鍵能數據
| 化學鍵 | Si-Si | O=O | Si-O |
| 鍵能/kJ·mol-1 | a | b | c |
 2NH3(g);△H<0,反應達到平衡后,測得混合氣體為7體積。
2NH3(g);△H<0,反應達到平衡后,測得混合氣體為7體積。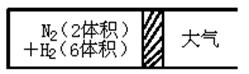
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com