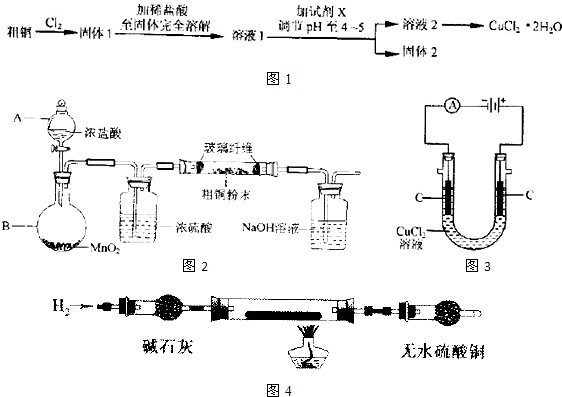
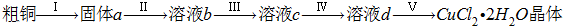解:(1)①儀器A是分液漏斗,故答案為:分液漏斗;
②制備氣體,應首先檢驗裝置的氣密性,故答案為:檢驗裝置氣密性;
③HCl對反應沒有影響,不需要在濃硫酸洗氣瓶前增加吸收HCl的裝置,故答案為:否;HCl不影響氯氣和粗銅的反應的產物;
④反應后尾氣含有氯氣,不能直接排放到空氣中,應用NaOH溶液進行尾氣的吸收,如圖
,故答案為:
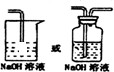
;
(2)步驟②為固體溶解的操作,操作方法為取固體1于燒杯中,加入適量稀鹽酸,用玻璃棒攪拌至固體全部溶解,
故答案為:取固體1于燒杯中,加入適量稀鹽酸,用玻璃棒攪拌至固體全部溶解;
(3)步驟③目的是調節溶液pH,使FeCl
3發生水解生成Fe(OH)
3沉淀而除去,則加入的物質應不能引入新雜質,可為Cu
2(OH)
2CO
3、CuO、CuCO
3等物質,發生反應的離子方程式為Cu
2(OH)
2CO
3+4H
+=2Cu
2++3H
2O+CO
2↑,從溶液中分離出固體,應用過濾的方法,
故答案為:c;Cu
2(OH)
2CO
3+4H
+=2Cu
2++3H
2O+CO
2↑;過濾;
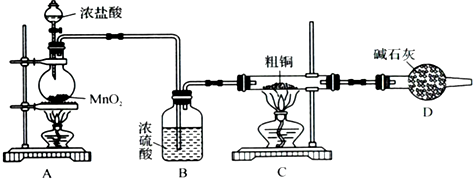
(4)a.將Y稀釋,平衡向左反應移動,溶液呈藍色,可以能夠證明CuCl
2溶液中轉化關系,故a正確;
b.在Y中加入CuCl
2晶體,溶液中Cu(H
2O)
42+濃度增大,平衡向右移動,溶液變為綠色,可以能夠證明CuCl
2溶液中轉化關系,故b正確;
c.在Y中加入NaCl固體,溶液中氯離子濃度增大,平衡向右移動,溶液變為綠色,可以能夠證明CuCl
2溶液中轉化關系,故c正確;
d.取Y進行電解,銅離子放電,溶液顏色最終消失,不能可以能夠證明CuCl
2溶液中轉化關系,故d錯誤.
故答案為:abc.
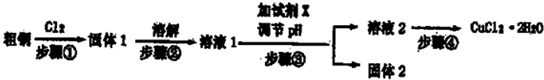
分析:粗銅中含有Fe,與氯氣反應生成CuCl
2和FeCl
3,步驟③目的是調節溶液pH,使FeCl
3發生水解生成Fe(OH)
3沉淀而除去,則加入的物質應不能引入新雜質,可為Cu
2(OH)
2CO
3、CuO、CuCO
3等物質,得到的溶液2為溶液CuCl
2,經蒸發濃縮,冷卻結晶可得到CuCl
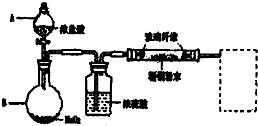
2晶體;實驗室用二氧化錳與濃鹽酸發生反應生成氯化錳、氯氣、水,反應離子方程式為MnO
2+4H
++2Cl
-
Mn
2++Cl
2↑+2H
2O,含有HCl、H
2O等雜質,必須經過除雜,以此解答該題.
點評:本題考查考查較為綜合,涉及物質的制備、檢驗和性質實驗設計等問題,側重于考查學生綜合運用化學知識的能力,為高考常見題型,難度中等.

 ,故答案為:
,故答案為: ;
; Mn2++Cl2↑+2H2O,含有HCl、H2O等雜質,必須經過除雜,以此解答該題.
Mn2++Cl2↑+2H2O,含有HCl、H2O等雜質,必須經過除雜,以此解答該題.