
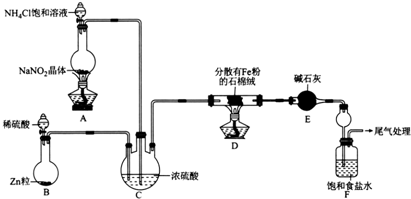
分析 (1)根據裝置圖可以知道裝置E中盛放堿石灰的儀器名稱;
(2)根據圖示,裝置A的作用是制備氮氣,氯化銨和亞硝酸鈉之間反應產生氮氣;
(3)裝置D中氮氣和氫氣按照一定的比例混合可以得到氨氣,裝置C的作用為使N2和H2混合均勻、干燥氮氣和氫氣、通過氣泡的溢出速率控制氮氣和氫氣的混合比例;
(4)加熱時空氣中的氧氣和水蒸氣和金屬鐵反應使金屬鐵失去金屬活性、氫氣和氧氣混合加熱爆炸,氫氣可以做保護氣,點燃之前要驗純;
(5)飽和氯化鈉可以吸收氨氣,得到堿性溶液,該溶液可以吸收二氧化碳氣體,得到溶解度較小的碳酸氫鈉晶體;
(6)根據溶度積常數的意義,知道先生成的是AgCl,再生成磚紅色的鉻酸銀,可以確定滴定終點的現象;氯化銨飽和溶液的物質的量濃度是2mol/L×0.026L÷0.01L=5.2mol/L.
解答 解:(1)根據裝置圖可以知道裝置E中盛放堿石灰的儀器名稱為干燥管,故答案為:干燥管;
(2)根據圖示,裝置A的作用是制備氮氣,氯化銨和亞硝酸鈉之間的反應為:NO2-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O,故答案為:NO2-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O;
(3)裝置D中氮氣和氫氣按照一定的比例混合可以得到氨氣,裝置C的作用為使N2和H2混合均勻、干燥氮氣和氫氣、通過氣泡的溢出速率控制氮氣和氫氣的混合比例,故答案為:干燥氮氣和氫氣;通過氣泡的溢出速率控制氮氣和氫氣的混合比例;
(4)實驗時,應先打開裝置B中分液漏斗活塞,反應一段時間,在裝置末端導管處收集H2并驗純后,再點燃D處酒精燈,這樣不但防止加熱時空氣中的氧氣和水蒸氣和金屬鐵反應使金屬鐵失去金屬活性,還可以防止氫氣和氧氣混合加熱爆炸,故答案為:防止加熱時空氣中的氧氣和水蒸氣和金屬鐵反應使金屬鐵失去金屬活性;防止氫氣和氧氣混合加熱爆炸;
(5)飽和氯化鈉可以吸收氨氣,得到堿性溶液,該溶液可以吸收二氧化碳氣體,得到溶解度較小的碳酸氫鈉晶體,即Na++CO2+NH3+H2O=NH4++NaHCO3;
故答案為:白色的晶體析出;Na++CO2+NH3+H2O=NH4++NaHCO3;
(6)根據溶度積常數的意義,知道先生成的是AgCl,再生成磚紅色的鉻酸銀,可以確定滴定終點的現象是:滴入最后一滴硝酸銀出現磚紅色沉淀,半分鐘內沉淀不消失,氯化銨飽和溶液的物質的量濃度是2mol/L×0.026L÷0.01L=5.2mol/L,故答案為:滴入最后一滴硝酸銀出現磚紅色沉淀,半分鐘內沉淀不消失;5.2mol/L.
點評 本題是一道考查侯氏制堿法原理的實驗方案設計題,注重元素化合物性質的考查,難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:實驗題
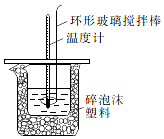 某實驗小組設計用50mL1.0mol/L鹽酸跟50mL1.1mol/L氫氧化鈉溶液在如圖裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:
某實驗小組設計用50mL1.0mol/L鹽酸跟50mL1.1mol/L氫氧化鈉溶液在如圖裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:| 實驗序號 | 起始溫度t1/℃ | 終止溫度(t2)℃ | 溫差(t2-t1)℃ | ||
| 鹽酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度 | 平衡時NH3的 物質的量mol |
| T1 | 1.2 |
| T2 | 1.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
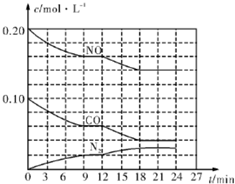 為有效控制霧霾,各地積極采取措施改善大氣質量.有效控制空氣中氮氧化物、碳氧化物和硫氧化物顯得尤為重要.在汽車排氣管內安裝催化轉化器,可將汽車尾氣中主要污染物轉化為無毒的大氣循環物質.熱化學反應方程式為 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,將1.0mol N0和1.0mol C0充入一個容積為10L的密閉容器中,反應過程中物質濃度變化如圖所示.
為有效控制霧霾,各地積極采取措施改善大氣質量.有效控制空氣中氮氧化物、碳氧化物和硫氧化物顯得尤為重要.在汽車排氣管內安裝催化轉化器,可將汽車尾氣中主要污染物轉化為無毒的大氣循環物質.熱化學反應方程式為 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,將1.0mol N0和1.0mol C0充入一個容積為10L的密閉容器中,反應過程中物質濃度變化如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
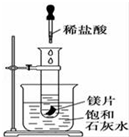 如圖所示,把試管放入盛有25℃飽和澄清石灰水的燒杯中,試管中開始放入幾小塊鎂片,再用滴管滴入10mL鹽酸于試管中,試回答下列問題:
如圖所示,把試管放入盛有25℃飽和澄清石灰水的燒杯中,試管中開始放入幾小塊鎂片,再用滴管滴入10mL鹽酸于試管中,試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 向甲容器中再充人一定量的氦氣 | B. | 向乙容器中再充人2mol的SO3氣體 | ||
| C. | 適當降低乙容器的溫度 | D. | 縮小甲容器的體積 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蓋斯 | B. | 勒•夏特列 | C. | 門捷列夫 | D. | 凱庫勒 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com