
【題目】硒(Se)是第四周期ⅥA族元素,是人體內不可或缺的微量元素,其氫化物H2Se是制備新型光伏太陽能電池、半導體材料和金屬硒化物的基礎原料。
T℃時,向一恒容密閉容器中加入3molH2和lmolSe,發生反應H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①當反應達到平衡后,將平衡混合氣體通入氣體液化分離器使H2Se氣體轉化為液體H2Se,并將分離出的H2再次通入發生反應的密閉容器中繼續與Se反應時,Se的轉化率會提高。請用化學平衡理論解釋___。
 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案科目:高中化學 來源: 題型:
【題目】淀粉通過如圖所示轉化可以得到多種有機物:
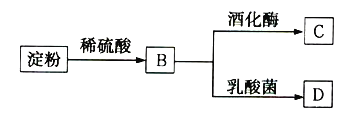
(1)檢驗淀粉是否完全水解,可以選用的試劑是__________(填序號)。
a.石蕊試液 b.淀粉碘化鉀溶液 c.碘水
(2)B是一種單糖,則B的名稱是____________________。
(3)B轉化為C的化學方程式是______________________________。
(4)一分子B可在乳酸菌作用下分解生成兩分子D,D與乙酸、乙醇均能發生酯化反應,且D的結構中含有甲基,則D的結構簡式是______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在2L的恒容密閉容器中充入氣體A和氣體B發生反應生成氣體C,反應過程中各組分的物質的量隨反應時間的變化如圖所示。下列說法正確的是( )
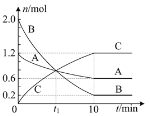
A.t1時刻反應達到平衡狀態
B.0~10min內平均速率v(B)=0.18mol·L-1·min-1
C.該反應的化學方程式可表示為:A+3B![]() 2C
2C
D.該溫度下,反應的平衡常數為1200
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】T℃時,A氣體與B氣體反應生成C氣體。反應過程中A、B、C濃度變化如圖(Ⅰ)所示,若保持其他條件不變,溫度分別為T1 ℃和T2 ℃時,B的體積分數與時間的關系如圖(Ⅱ)所示,則下列結論正確的是( )
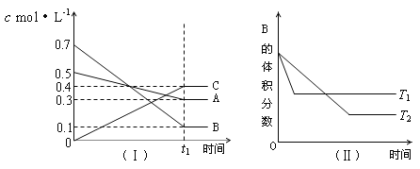
A.該平衡體系的化學反應方程式為:A(g)+B(g)![]() C(g)
C(g)
B.(t1+10)min時,保持容器總壓強不變,通入稀有氣體,平衡向逆反應方向移動
C.T1<T2
D.其他條件不變,升高溫度,正、逆反應速率均增大,且A的轉化率增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用濃度為0.01mol·L-1的HA溶液滴定20mL濃度為0.01mol·L-1的NaOH溶液,滴定曲線如圖所示。下列說法錯誤的是( )

A. 應選用酚酞作指示劑
B. M點溶液中存在:c(Na+)>c(A-)
C. Ka(HA)≈2×10-8
D. N點溶液中存在:c(OH-)-c(H+)=c(HA)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)檢驗氣體中是否含有CO的實驗操作:將該氣體通入氯化鈀(PdCl2)溶液中,觀察是否有黑色的單質鈀生成,寫出對應的化學方程式:_______________。
(2)生產硫化鈉大多采用無水芒硝(Na2SO4)—炭粉還原法,若煅燒所得氣體為等物質的量的CO和CO2,寫出煅燒時發生反應的化學方程式:_________________。
(3)加入雙氧水能提高軟錳礦(主要成分是MnO2)的浸出率,錳轉化成Mn2+。寫出酸性條件下雙氧水提高軟錳礦浸出率的離子方程式:______________________________。
(4)在酸性、有氧條件下,一種叫Thibacillus ferroxidans的細菌能將黃銅礦(主要成分為CuFeS2)轉化成硫酸鹽,該過程反應的離子方程式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列相關離子方程式書寫正確的是![]()
A.![]() 溶液與少量的氫氧化鈉溶液混合加熱:
溶液與少量的氫氧化鈉溶液混合加熱:![]()
B.向![]() 溶液中加入過量的澄清石灰水:
溶液中加入過量的澄清石灰水:![]()
C.等物質的量的![]() 和
和![]() 在溶液中的反應:
在溶液中的反應:![]()
D.“84消毒液”和“潔廁靈”![]() 主要成分為鹽酸
主要成分為鹽酸![]() 混合使用會產生有毒氣體:
混合使用會產生有毒氣體:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將等量的N2和H2的混合氣體分別充入甲、乙、丙三個容器中,進行反應![]() ,經過相同的時間后,測得反應速率分別為甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。則三個容器中合成氨的反應速率大小關系為( )
,經過相同的時間后,測得反應速率分別為甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。則三個容器中合成氨的反應速率大小關系為( )
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中充入1molH2和1molI2,壓強為P(Pa),并在一定溫度下反應:H2(g)+I2(g)![]() 2HI(g)△H<0.寫出下列條件下反應速率的變化(填“增大”,“減小”或“不變”)
2HI(g)△H<0.寫出下列條件下反應速率的變化(填“增大”,“減小”或“不變”)
(1)容積不變,加入1molH2,其正反應速率的變化是___。
(2)升高溫度,其逆反應速率的變化是___。
(3)壓強不變,加入1molHe,其正反應速率的變化是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com