
(1)我國目前多用煅燒黃鐵礦的方法來制備二氧化硫,該反應的化學方程式為___________
________________________________,該反應常在______________________(填寫設備名稱)內進行。

(2)現有A、B、C、D四地的地理位置如圖所示,交通均較為便利,其他地理條件如下:A地是風景旅游城市;B地是硫酸消費中心;C地有較為豐實的黃鐵礦資源;D地有少量的硫酸消費。則硫酸工廠廠址應選擇在___________地。
(3)如果某廠生產98%的濃硫酸100 t,在生產過程中硫的總損耗率為2%,則需要含FeS260%的黃鐵礦____________t。
科目:高中化學 來源: 題型:閱讀理解
| 壓強MPa 轉化率% 溫度℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
查看答案和解析>>
科目:高中化學 來源:2014屆河北省高一下學期期末考試化學試卷(解析版) 題型:選擇題
硫酸是一種重要的化工產品,硫酸的消耗量常被視為一個國家工業發達水平的一種標志。反應2SO2+O2 2SO3是工業制硫酸的主要反應之一,以下說法不正確的是
2SO3是工業制硫酸的主要反應之一,以下說法不正確的是
A.該反應為可逆反應,故在一定條件下二氧化硫和氧氣不可能全部轉化為三氧化硫
B.達到平衡后,反應就停止了,故正、逆反應速率相等且均為零
C.一定條件下,向某密閉容器中加入2 mol SO2和1 mol O2,則從反應開始到達到平衡的過程中,正反應速率不斷減小,逆反應速率不斷增大,某一時刻,正、逆反應速率相等
D.在利用上述反應生產三氧化硫時,要同時考慮反應所能達到的限度和化學反應速率兩方面的問題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
二氧化硫在工業制硫酸中有著重要作用,但又是煤燃燒的有害氣體.按“循環經濟”的模式,就是要將SO2收集起來,把它變為有用的東西.
(1)某空氣監測是根據SO2和溴水的定量反應來測定SO2的含量.該反應的化學方程式為______.
(2)若每次取樣的空氣為200mL,通人足量的溴水中,測得平均有2.408×1018個電子轉移,則SO2的含量為______mg?L-1,若規定空氣中SO2含量不得超過0.02mg?L-1,則樣氣是否符合大氣的質量標準______(填“符合”或“不符合”).
(3)向氯酸鈉的酸性水溶液中通入二氧化硫,該反應中氧化過程的反應式為:SO2+2H2O-2e-→SO42-+4H+;向亞氯酸鈉(NaClO2)固體中通入用空氣稀釋的氯氣,該反應中還原過程的反應式為:Cl2+2e-→2Cl-.在上述兩個反應中均會生成產物X,則X的化學式為______.
A. NaClO B.NaClO4 C.HClO D.ClO2
(4)在硫酸工業制法中,下列敘述正確的是______.
A.硫鐵礦燃燒前要粉碎,因為大塊的黃鐵礦不能在空氣中反應
B.從沸騰爐出來的氣體要凈化,因為爐氣中的SO2會與雜質反應
C.SO2氧化成SO3要用催化劑,這樣可提高SO2的轉化率
D.SO3用98.3%的濃硫酸來吸收,目的是為了防止形成酸霧,以提高SO3吸收效率
(5)如表是壓強對SO2平衡轉化率的影響
| 壓強MPa 轉化率% 溫度℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
對于SO2轉化SO3的反應,增大壓強可使轉化率______(填“增大”、“減少”或“不變”),但在實際工業生產中常采用常壓條件,理由是______.
查看答案和解析>>
科目:高中化學 來源: 題型:
硫酸是重要的化工材料,二氧化硫生成三氧化硫是工業制硫酸的重要反應之一。
(1)將0.050 mol SO2(g)和0.030 mol O2(g)放入容積為1 L的密閉容器中,反應
2SO2(g)+O2(g)![]() 2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040 mol/L。
2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040 mol/L。
① 從平衡角度分析采用過量O2的目的是 ;
② 計算該條件下反應的平衡常數K=___________。ks5u
③ 已知:K(300℃)>K(350℃),該反應是________熱反應。若反應溫度升高,SO2的轉化率 (填“增大”、“減小”或“不變”)。
(2)某溫度下,SO2的平衡轉化率(α)與體系總壓強(P)的關系如圖1所示。平衡狀態由A變到B時,平衡常數K(A)_______K(B)(填“>”、“<”或“=”,下同)。
(3)如圖2所示,保持溫度不變,將2 mol SO2和1 mol O2加入甲容器中,將4 mol SO3加入乙容器中,隔板K不能移動。此時控制活塞P,使乙的容積為甲的2倍。
①若移動活塞P,使乙的容積和甲相等,達到新平衡時,SO3的體積分數甲 乙。
②若保持乙中壓強不變,向甲、乙容器中通入等質量的氦氣,達到新平衡時,SO3的體積分數甲 乙。(在①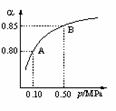 、②填入:大于、等于、小于)
、②填入:大于、等于、小于)

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com