
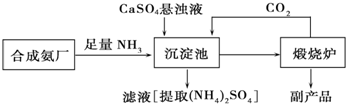
分析 工業合成氨的反應原理為N2+3H2$\frac{\underline{\;\;催化劑\;\;}}{高溫高壓}$2NH3,將NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,發生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,CaCO3在煅燒爐中分解生成CO2和CaO,CO2可循環使用,
(1)氮氣和氫氣在高溫高壓、催化劑條件下反應生成氨氣,該反應在合成塔中進行,催化劑為鐵觸媒;
(2)CaCO3溶解度小于CaSO4,則沉淀池中硫酸鈣與二氧化碳、氨氣、水反應生成碳酸鈣沉淀和硫酸銨;
(3)碳酸鈣高溫下分解生成氧化鈣和二氧化碳,二氧化碳可以循環利用,氧化鈣為副產品;
(4)從反應原理及可循環利用物質、副產品及是否有污染物生成等角度分析.
解答 解:(1)工業合成氨的反應原理為:N2+3H2$\frac{\underline{\;\;催化劑\;\;}}{高溫高壓}$2NH3;該反應在合成塔中進行,需要使用鐵觸媒做催化劑,
故答案為:N2+3H2 $\frac{\underline{\;\;催化劑\;\;}}{高溫高壓}$2NH3;合成塔;鐵觸媒;
(2)將NH3和CO2通入沉淀池中并加入CaSO4,由于生成的CaCO3溶解度小于CaSO4有利于反應向正向進行,則反應生成(NH4)2SO4和CaCO3,反應的化學方程式為:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,
故答案為:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;生成的CaCO3溶解度小于CaSO4有利于反應向正向進行;
(3)CaCO3在煅燒爐中分解生成CO2和CaO,CO2可循環使用,副產品為生石灰,
故答案為:CO2;生石灰;
(4)根據反應流程離子,該反應的有點為:生成的CO2可循環使用,CaO可制備硫酸鈣,沒有廢物生成,
故答案為:該流程中產生的CO2循環使用,得到的產品和副產品都是有用的物質,無廢物產生.
點評 本題考查工業合成氨,題目難度中等,明確合成流程及反應原理為解答關鍵,試題側重考查學生的分析、理解能力及靈活應用基礎知識的能力,(2)為易錯點,需要從難溶物溶解平均及其轉化實質角度考慮.


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 Ⅰ.甲硅烷(SiH4)常溫下是一種無色氣體,遇空氣發生自燃.
Ⅰ.甲硅烷(SiH4)常溫下是一種無色氣體,遇空氣發生自燃.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
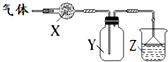 如圖裝置用于氣體的干燥、收集和尾氣吸收,其中X、Y、Z對應都正確的是( )
如圖裝置用于氣體的干燥、收集和尾氣吸收,其中X、Y、Z對應都正確的是( )| X | Y | Z | |
| A | 無水硫酸銅 | 氯氣 | 飽和食鹽水 |
| B | 堿石灰 | 氨氣 | 水 |
| C | 氯化鈣 | 二氧化硫 | 氫氧化鈉 |
| D | 氯化鈣 | 一氧化氮 | 氫氧化鈉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
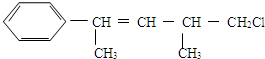
| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 能使溴水褪色 | |
| C. | 在加熱和催化劑作用下,最多能和4 molH2反應 | |
| D. | 一定條件下,能發生取代反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子序數:X>Y>Z>W | |
| B. | Y的氣態氫化物的熱穩定性比W的強 | |
| C. | 原子半徑的大小順序:r(Z)>r(Y)>r(W)>r(X) | |
| D. | X分別與Y、Z形成的化合物中化學鍵類型相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
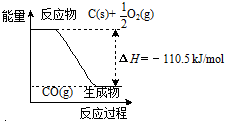
| A. | 12gC(s)與一定量O2(g)反應生成14g CO(g),放出的熱量為110.5kJ | |
| B. | 該反應的反應熱等于CO分子中化學鍵形成時所釋放的總能量與O2分子中化學鍵斷裂時所吸收的總能量的差 | |
| C. | 該反應的熱化學方程式是2C(s)+O2(g)=2CO(g)△H=-221kJ | |
| D. | 2molC(s)與足量O2(g)反應生成CO2(g),放出的熱量大于221kJ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com