
(16分)(1)事實證明,能設計成原電池的反應通常是放熱反應,下列化學反應在理論上可以設計成原電池的是
A.C(s)+H2O(g)= CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)= 2H2O(1) △H<0
(2)電解原理在化學工業中有著廣泛的應用。現將你設計的原電池通過導線與下圖中電解池相連,其中a為電解液,X和Y均為惰性電極,則:
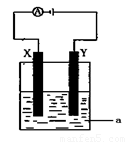
①若a為CuSO4溶液,則電解時的化學反應方程式為 。通過一段時間后,向所得溶液中加入0.2molCuO粉末,恰好恢復電解前的狀態,則電解過程中轉移的電子的物質的量為
②若電解含有1molNaCl溶液400ml,當陽極產生的氣體448mL(標準狀況下)時,溶液的C(OH—) = (假設電解后溶液體積不變)。
科目:高中化學 來源: 題型:閱讀理解
(16分)現有A、B、C、D、E、F六種短周期元素,它們的原子序數依次增大,D與E的氫化物分子構型都是V型。A、B的最外層電子數之和與C的最外層電子數相等,A能分別與B、C、D形成電子總數相等的分子,且A與D可形成的化合物,常溫下均為液態。請回答下列問題(填空時用實際符號):
(1)C的元素符號是 ;元素F在周期表中的位置 。
(2)B與D一般情況下可形成兩種常見氣態化合物,假若現在科學家制出另一種直線型氣態化合物 B2D2分子,且各原子最外層都滿足8電子結構,則B2D2電子式為 ,其固體時的晶體類型是 。
(3)最近意大利羅馬大學的FuNvio Cacace等人獲得了極具理論研究意義的C4分子。C4分子結構如右圖所示,已知斷裂lmolC-C吸收167kJ熱量,生成Imo1C=C放出942kJ熱量。根據以上信息和數據,下列說法正確的是 。
①C4屬于一種新型的化合物
②C4沸點比P4(白磷)低
③lmol C4氣體轉變為C2吸收882kJ熱量
④C4與C2互為同素異形體
⑤C4穩定性比P4(白磷)差
⑥C4屬于原子晶體
⑦C4和P4 (白磷)的晶體都屬于分子晶體
⑧C4與C2互為同分異構體
(4)C與F兩種元素形成一種化合物分子,各原子最外層達8電子結構,則該分子的結構式為 ,其空間構型為 。
(5)為了除去化合物乙(A2ED4);)稀溶液中混有的A2ED3,常采用A2D2為氧化劑,發生反應的離子方程式為:
(6)E與F形成的化合物E2F2在橡膠工業上有重要用途,遇水易水解,其空間結構與A2D2極為相似。對此以下說法正確的是 。
a.E2F2的結構式為:F-E—E- F
b.E2F2為含有極性鍵 和非極性鍵的非極性分子
c.E2Br2與E2F2結構相似,熔沸點:E2Br2> E2F2
d.E2F2與H2O反應的化學方程式可能為:2 E2F2+2H2O=EO2↑+ 3E↓+4HF
(7)舉出一種事實說明E與F的非金屬性強弱(用化學方程式或用語言文字表達均可):
查看答案和解析>>
科目:高中化學 來源:2014屆浙江省高一下學期第一次階段性測試化學試卷(解析版) 題型:填空題
(16分) 下表為元素周期表的一部分,請參照元素①-⑧在表中的位置,用化學用語
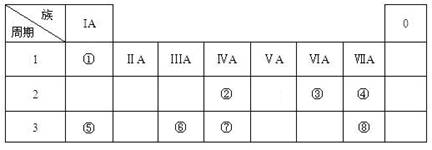
回答下列問題:
(1)④、⑤、⑥的原子半徑由大到小的順序為_______________________,②、⑦、⑧的最高價含氧酸的酸性由強到弱的順序是______________________。
(2)由表中兩種元素的原子按1:1組成的常見液態化合物的稀液易被催化分解,可使用的催化劑為(填序號)_________________。
a.MnO2 b.FeCl 3 c.Na2SO3 d.KMnO4
若已知1 克該液態化合物分解成③的單質和一種常見液體時,可放出2.9kJ能量,寫出該反應的熱化學方程式:
(3)工業上常采用電解A和冰晶石(Na3AlF6)混合物的方法冶煉制備⑥的單質,請從A晶體的類型和微粒間的相互作用力角度解釋加冰晶石(Na3AlF6)的原因 。 并寫出電解時的電極反應式: 。
(4)甲、乙、丙是上述部分元素組成的雙原子分子或負二價雙原子陰離子,且甲、乙、丙的電子總數相等。甲是一種極強的氧化性單質。丙與⑤的陽離子可形成一種淡黃色固體B,該固體跟水反應可得到③的單質。則B電子式 ,乙的結構式 ,甲的組成元素的原子結構示意圖 ,能證明甲的組成元素非金屬性很強的事實 。(任舉一例即可)
查看答案和解析>>
科目:高中化學 來源:河北省10-11學年高一下學期期末考試(化學理)B卷 題型:填空題
(每空2分,共16分)依據事實,填空:
(1)在25℃、101kPa下,1g甲醇液體完全燃燒生成CO2和液態水時放熱22.68kJ。則表示甲醇燃燒熱的熱化學方程式為_____________________________
(2)已知拆開1molH-H鍵,1molN-H鍵,1molN≡N鍵分別需要的能量是436kJ、391kJ、946kJ,則N2與H2反應生成NH3的熱化學方程式為_________________
(3)氫氧燃料電池已用于航天飛機。以30%KOH溶液為電解質的這種電池在使用時的電極反應式: 正極: ;負極:
(4)在25℃時,密閉容器中X、Y、Z三種氣體的初始濃度和平衡濃度如下表:
|
物質 |
X |
Y |
Z |
|
初始濃度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡濃度/mol·L-1 |
0.05 |
0.05 |
0.1 |
該反應的反應方程式可表示為 ,平衡時Y氣體的轉化率 。
(5)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸銀溶液20 ml才能把氯離子完全沉淀下來。則X的質量數為 ;若X的核內中子數為20,則37 g XCl2中所含質子的物質的量 。
查看答案和解析>>
科目:高中化學 來源:2010年江西省高三熱身卷(理科綜合)化學部分 題型:填空題
(16分)現有A、B、C、D、E、F六種短周期元素,它們的原子序數依次增大,D與E的氫化物分子構型都是V型。A、B的最外層電子數之和與C的最外層電子數相等,A能分別與B、C、D形成電子總數相等的分子,且A與D可形成的化合物,常溫下均為液態。請回答下列問題(填空時用實際符號):
(1)C的元素符號是 ;元素F在周期表中的位置 。
(2)B與D一般情況下可形成兩種常見氣態化合物,假若現在科學家制出另一種直線型氣態化合物 B2D2分子,且各原子最外層都滿足8電子結構,則B2D2電子式為 ,其固體時的晶體類型是 。
(3)最近意大利羅馬大學的FuNvio Cacace等人獲得了極具理論研究意義的C4分子。C4分子結構如右圖所示,已知斷裂lmolC-C吸收167kJ熱量,生成Imo1C=C放出942kJ熱量。根據以上信息和數據,下列說法正確的是 。

① C4屬于一種新型的化合物
② C4沸點比P4(白磷)低
③ lmol C4氣體轉變為C2吸收882kJ熱量
④ C4與C2互為同素異形體
⑤ C4穩定性比P4(白磷)差
⑥ C4屬于原子晶體
⑦ C4和P4 (白磷)的晶體都屬于分子晶體
⑧ C4與C2互為同分異構體
(4)C與F兩種元素形成一種化合物分子,各原子最外層達8電子結構,則該分子的結構式為 ,其空間構型為 。
(5)為了除去化合物乙(A2ED4);)稀溶液中混有的A2ED3,常采用A2D2為氧化劑,發生反應的離子方程式為:
(6)E與F形成的化合物E2F2在橡膠工業上有重要用途,遇水易水解,其空間結構與A2D2極為相似。對此以下說法正確的是 。
a.E2F2的結構式為:F- E—E- F
b.E2F2為含有極性鍵 和非極性鍵的非極性分子
c.E2Br2與E2F2結構相似,熔沸點:E2Br2> E2F2
d.E2F2與H2O反應的化學方程式可能為:2 E2F2+2H2O=EO2↑+ 3E↓+4HF
(7)舉出一種事實說明E與F的非金屬性強弱(用化學方程式或用語言文字表達均可):
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com