
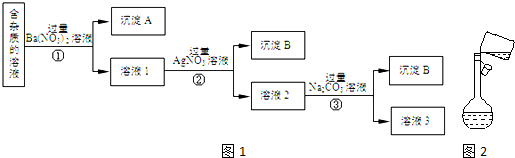
分析 由實驗流程可知,加入過量的Ba(NO3)2,生成BaSO4、BaCO3沉淀,然后在濾液中加入過量的AgNO3,使Cl-全部轉化為AgCl沉淀,在所得濾液中加入過量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液為NaNO3和Na2CO3的混合物,加入稀HNO3,最后進行蒸發操作可得固體NaNO3.根據配制一定濃度的溶液步驟操作.
解答 解:(1)加入過量的Ba(NO3)2,Na2SO4、Na2CO3和Ba(NO3)2反應生成BaSO4、BaCO3沉淀,故答案為:BaSO4、BaCO3;
(2)濾液1中含氯離子,加入過量的AgNO3,使Cl-全部轉化為AgCl沉淀,反應的離子方程式為:Ag++Cl-═AgCl↓;故答案為:Ag++Cl-═AgCl↓;
(3)①②③中均進行的分離是把不溶性物質和可溶性物質分離,故為過濾,故答案為:過濾;
(4)溶液3為NaNO3和Na2CO3的混合物,加入稀HNO3,可除去Na2CO3,最后加熱蒸發、冷卻結晶、過濾得到硝酸鈉,故答案為:Na2CO3;HNO3;
(5)①制備500mL 0.4mol/L的NaNO3溶液,需要500mL容量瓶,則需要硝酸鈉的質量為0.5L×0.4mol/L×85g/mol=17.0g,配制的步驟依次為計算、稱量、溶解、轉移、洗滌、定容、搖勻等操作,故第四步為轉移,
故答案為:17.0;e;
②配制一定物質的量濃度的溶液需要500mL容量瓶,向容量瓶中轉移液體需要用玻璃棒引流,故答案為:未用玻璃棒引流;
③若用膠頭滴管定容時,不小心滴水滴過了刻度線,濃度偏小,需重新配制,故答案為:重新配制;
④a.未洗滌玻璃棒和燒杯,溶質偏少,濃度偏低;
b.定容時俯視刻度線,體積偏小,濃度偏大;
c.容量瓶中殘留水分,溶質的物質的量不變,故濃度無影響,
故答案為:a.
點評 本題考查物質的分離提純操作和一定物質的量濃度溶液的配制,題目難度中等,本題注意Cl-、SO42-的性質,把握除雜原則,提純時不能引入新的雜質,注意把握實驗的先后順序.


科目:高中化學 來源: 題型:選擇題
| A. | 1 mol 氧氣中含有12.04×1023個氧原子,在標準狀況下占有體積22.4 L | |
| B. | 1 mol臭氧和1.5 mol氧氣含有相同的氧原子數 | |
| C. | 等體積、濃度均為1 mol•L-1的磷酸和鹽酸,H3PO4和HCl含有的氫元素質量之比為1:1 | |
| D. | 等物質的量的干冰和葡萄糖(C6H12O6)中所含碳原子數之比為1:6,氧原子數之比為1:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na與水反應:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 0.01mol/L NH4Al(SO4)2溶液與0.02mol/L Ba(OH)2溶液等體積混合 NH4++Al3++2SO42-+2Ba2++4 OH-═2 Ba SO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 硅酸鈉溶液與醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| D. | 濃硝酸中加入過量鐵粉并加熱:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.3 mol•L-1的Na2SO4溶液中含有Na+和SO42-的總物質的量為0.9 mol | |
| B. | 當1 L水吸收22.4 L氨氣時所得氨水的濃度不是1 mol•L-1,只有當22.4 L氨氣溶于水制得1 L氨水時,其濃度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物質的量相等,則K+和Cl-的物質的量濃度一定相同 | |
| D. | 10℃時,100 mL 0.35 mol•L-1的KCl飽和溶液蒸發掉5g水,冷卻到10℃時,其體積小于100 mL,它的物質的量濃度仍為0.35 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 當生成沉淀達到最大量時,消耗NaOH溶液的體積為150mL | |
| B. | 當金屬全部溶解時收集到NO氣體的體積為4.48L(標準狀況下) | |
| C. | 參加反應的金屬的總質量一定是9.9g | |
| D. | 當金屬全部溶解時,參加反應的硝酸的物質的量一定是0.6mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
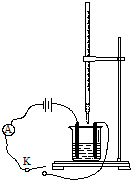 如圖,向堿式滴定管和燒杯中分別注入0.2mol•L-1Ba(OH)2溶液和0.1mol•L-1稀硫酸各50mL,并向稀硫酸中滴加幾滴石蕊溶液,按如圖裝置連接好.
如圖,向堿式滴定管和燒杯中分別注入0.2mol•L-1Ba(OH)2溶液和0.1mol•L-1稀硫酸各50mL,并向稀硫酸中滴加幾滴石蕊溶液,按如圖裝置連接好.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com