
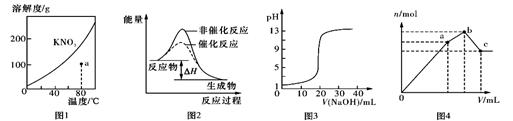
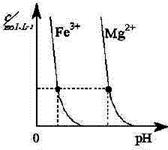
| A.圖1表示KNO3的溶解度曲線,a點所示的溶液是80℃時KNO3不飽和溶液 |
| B.圖2表示某放熱反應分別在有、無催化劑的情況下反應過程中的能量變化 |
| C.圖3表示0.1000mol/LNaOH滴定20.00 mL 0.1000mol/L醋酸的滴定曲線 |
| D.圖4表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,體積V與沉淀n的變化 |
科目:高中化學 來源:不詳 題型:單選題
| A.該過程吸收的熱量為86.7 kJ |
| B.此過程中需要標準狀況下CH4氣體1.12 L |
| C.轉移的電子數為0.8NA |
| D.已知2NO(g)+O2(g)=2NO2(g) ΔH=-114 kJ·mol-1,則CH4的燃燒熱是802 kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:計算題
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
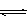 CH3OH(g)
CH3OH(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
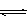 CH3OH(g)的化學平衡常數為__________.
CH3OH(g)的化學平衡常數為__________.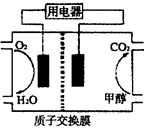
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.SO2的催化氧化是一個放熱的反應,升高溫度,反應速率加快 |
| B.“冰,水為之,而寒于水”說明相同質量的水和冰,水的能量較高 |
C.A(g)+3B(g)  2C(g)達平衡后,恒溫,增壓,平衡正向移動,平衡常數K值增大 2C(g)達平衡后,恒溫,增壓,平衡正向移動,平衡常數K值增大 |
| D.在KI溶液中加入氯化銀固體,沉淀變成黃色,說明同溫度下Ksp(AgI)< Ksp(AgCl) |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 H2+I2(g)
H2+I2(g) 
 H++OH-)平衡 移動(填“向左”“向右”或者“不”);若要減小產生H2的速率而又不影響產生H2的總量,應向硫酸中加入下列試劑中的 。
H++OH-)平衡 移動(填“向左”“向右”或者“不”);若要減小產生H2的速率而又不影響產生H2的總量,應向硫酸中加入下列試劑中的 。查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.平衡常數的大小與溫度、濃度、壓強、催化劑等有關 |
| B.當溫度升高時,弱酸的電離平衡常數Ka變小 |
| C.KSP(AgCl) > KSP(AgI) ,由此可以判斷AgCl(s) + I-(aq)= AgI(s)+ Cl-(aq)能夠發生 |
| D.Ka(HCN) < Ka(CH3COOH) ,說明物質的量濃度相同時,氫氰酸的酸性比醋酸強 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 CO(g)+H2(g);ΔH= 。(用含ΔH1、ΔH2的代數式表示)
CO(g)+H2(g);ΔH= 。(用含ΔH1、ΔH2的代數式表示) CH3OH(g);ΔH3。現在容積均為1L的a、b、c、d、e五個密閉容器中分別充入1mol CO和2mol H2的混合氣體,控溫,進行實驗測得相關數據如下圖1和圖2。
CH3OH(g);ΔH3。現在容積均為1L的a、b、c、d、e五個密閉容器中分別充入1mol CO和2mol H2的混合氣體,控溫,進行實驗測得相關數據如下圖1和圖2。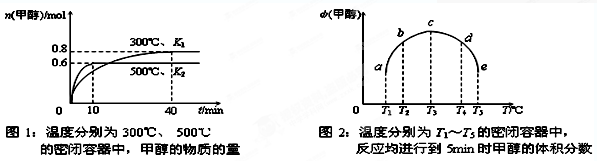
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| A.升高溫度 | B.加入催化劑 | C.將XQ3及時分離出去 | D.增大反應體系的壓強 |
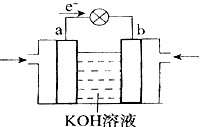
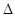 H=-393.5kJ/mol
H=-393.5kJ/mol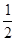 Y2(g)=WY2(g);
Y2(g)=WY2(g);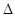 H=-238.0kJ/mol。則 24g W與一定量的Y2反應,放出熱量362.5 kJ,所得產物成分及物質的量之比為 。
H=-238.0kJ/mol。則 24g W與一定量的Y2反應,放出熱量362.5 kJ,所得產物成分及物質的量之比為 。查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com