
(2)某學生判斷SO2和Na2O2反應能生成硫酸鈉,你認為他的判斷合理嗎?(填“合理”或“不合理”)__________。簡要說明理由___________________________________________。
(3)該同學無法確定反應中是否有氧氣生成,擬用如下圖所示裝置進行實驗。
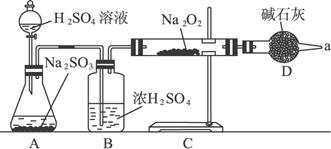
裝置B的作用是_________________________________________________。D的作用是:________________________________________。
(4)為確認反應產物,請完成下表中所列實驗
操作 | 現象與結論 |
①確認是否有氧氣產生的操作是: |
|
②確認是否有硫酸鈉產生的操作是: |
|
解析:本題中CO2與Na2O2反應這一主干知識,延伸為SO2與Na2O2反應產物的判斷與檢驗。SO2與CO2相比較兩者共同之處在于均為酸性氧化物,不同之處在于SO2具有較強的還原性。所以SO2與Na2O2的反應與CO2與Na2O2的反應應有相似之處又存在區別。在反應過程中,由于Na2O2的強氧化性,S元素的化合價應由+4價升高到+6價,反應產物中可能會生成O2。O2的檢驗可利用其特征檢驗法:能使帶火星的木條復燃。
答案:
(1)2Na2O2+2CO2====2Na2CO3+O2
(2)合理 因為Na2O2有強氧化性,SO2有還原性
(3)干燥SO2 吸收多余SO2,防止空氣進入C中,從而使Na2O2與空氣中的水分和CO2反應
(4)
操作 | 現象與結論 |
①將帶火星木條接近a口木條復燃,證明有O2生成 | 木條不復燃,證明無O2生成 |
②將C中固體溶入稀HCl后再加入BaCl2溶液 | 有沉淀產生,證明有Na2SO4生成無沉淀產生,證明無Na2SO4生成 |


科目:高中化學 來源: 題型:
 (2013?淄博二模)(1)寫出Co2+離子基態的價電子排布式:
(2013?淄博二模)(1)寫出Co2+離子基態的價電子排布式:查看答案和解析>>
科目:高中化學 來源: 題型:
 通常人們把拆開1mol 某化學鍵所吸收的能量看成該化學鍵的鍵能.鍵能的大小可用于估算化學反應的反應熱(△H).
通常人們把拆開1mol 某化學鍵所吸收的能量看成該化學鍵的鍵能.鍵能的大小可用于估算化學反應的反應熱(△H).| 化學鍵 | Cl-Cl | H-H | H-Cl | N≡N |
| 鍵能/kJ?mol | 243 | 436 | 431 | 946 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:




查看答案和解析>>
科目:高中化學 來源:2013-2014學年浙江省六市六校聯盟高考模擬考試理科綜合化學試卷(解析版) 題型:填空題
“低碳循環”引起各國的高度重視,而如何降低大氣中CO2的含量及有效地開發利用CO2,引起了全世界的普遍重視。所以“低碳經濟”正成為科學家研究的主要課題。
(1)寫出CO2與H2反應生成CH4和H2O的熱化學方程式???????????????????? 。
已知:? ① CO(g)+H2O(g) H2(g)+CO2(g)??? ΔH=-41kJ·mol-1
H2(g)+CO2(g)??? ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g)??????????? ΔH=-73kJ·mol-1
CH4(g)??????????? ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g)???? ????? ΔH=-171kJ·mol-1
C(s)+CO2(g)???? ????? ΔH=-171kJ·mol-1
(2)將燃煤廢氣中的CO2轉化為二甲醚的反應原理為:2CO2(g) + 6H2(g)  CH3OCH3(g) + 3H2O(g)。已知一定條件下,該反應中CO2的平衡轉化率隨溫度、投料比[n(H2) / n(CO2)]的變化曲線如下左圖:
CH3OCH3(g) + 3H2O(g)。已知一定條件下,該反應中CO2的平衡轉化率隨溫度、投料比[n(H2) / n(CO2)]的變化曲線如下左圖:
①在其他條件不變時,請在上圖中畫出平衡時CH3OCH3的體積分數隨投料比[n(H2) / n(CO2)]變化的曲線圖。

②某溫度下,將2.0molCO2(g)和6.0molH2(g)充入容積為2L的密閉容器中,反應到達平衡時,改變壓強和溫度,平衡體系中CH3OCH3(g)的物質的量分數變化情況如圖所示,關于溫度和壓強的關系判斷正確的是??? ? ??? ?? ;

A. P3>P2,T3>T2???????? B. P1>P3,T1>T3??? C. P2>P4,T4>T2???????? D. P1>P4,T2>T3
③在恒容密閉容器里按體積比為1:3充入二氧化碳和氫 氣,一定條件下反應達到平衡狀態。當改變反應的某一個條件后,下列變化能說明平衡一定向逆反應方向移動的是 ????? ;
A. 正反應速率先增大后減小
B. 逆反應速率先增大后減小
C. 化學平衡常數K值增大
D. 反應物的體積百分含量增大
E. 混合氣體的密度減小
F. 氫氣的轉化率減小
(3)最近科學家再次提出“綠色化學”構想:把空氣吹入碳酸鉀溶液,然后再把CO2從溶液中提取出來,經化學反應后使空氣中的CO2轉變為可再生燃料甲醇。甲醇可制作燃料電池,寫出以稀硫酸為電解質甲醇燃料電池負極反應式__?????????????????????????? ?? 。以此燃料電池作為外接電源按圖所示電解硫酸銅溶液,如果起始時盛有1000mL pH=5的硫酸銅溶液(25℃,CuSO4足量),一段時間后溶液的pH變為1,此時可觀察到的現象是????????????????????? ;若要使溶液恢復到起始濃度(溫度不變,忽略溶液體積的變化),可向溶液中加入?????? (填物質名稱),其質量約為??? g。

查看答案和解析>>
科目:高中化學 來源:2013屆河北省高一下學期期末考試化學試卷 題型:填空題
(10分)通常人們把拆開1mol 某化學鍵所吸收的能量看成該化學鍵的鍵能。鍵能的大小可用于估算化學反應的反應熱(△H)。
|
化學鍵 |
Cl-Cl |
H—H |
H—Cl |
N≡N |
|
鍵能/kJ·mol |
243 |
436 |
431 |
946 |
(1)按要求完成填空
a 2HCl(g) = H2(g)+Cl2(g);△H=
b N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,則N—H鍵的鍵能是 kJ·mol
(2)1 mol NO2和1mol CO反應生成CO2和NO過程中能量變化示意圖,請寫出NO2和CO反應的熱化學方程式

(3) 已知在常溫常壓下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
則CH3OH(l)+O2(g)= CO(g) + 2H2O(l)ΔH = (用含ΔH1、ΔH2、ΔH3的式子表示)
(4) 已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H= -1 644.3 kJ• mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H= -815.88 kJ• mol-1
試寫出鋁粉與氧化鐵粉末發生鋁熱反應的熱化學方程式_______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com