
【題目】I.下表是元素周期表的一部分。表中所列的字母分別代表一種化學元素。
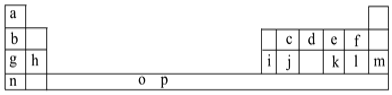
試回答下列問題:
(1)元素p為26號元素,請寫出其基態原子電子排布式:___。
(2)d與a反應的產物的分子中中心原子的雜化形式為___,該分子是___(填“極性”或“非極性”)分子。
(3)h的單質在空氣中燃燒發出耀眼的白光,請用原子結構的知識解釋發光的原因:__。
(4)o、p兩元素的部分電離能數據列于下表:
元素 | o | p | |
電離能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比較兩元素的I2、I3可知,氣態o2+再失去一個電子比氣態p2+再失去一個電子難。對此,你的解釋是___。
II.(1)基態硫原子中,核外占據最高能級電子的電子云輪廓圖形狀為__。硫的一種同素異形體分子式為S8,其結構如圖所示,其中S原子的雜化軌道類型為___。S8易溶于二硫化碳的原因是___。
![]()
(2)教材插圖具有簡潔而又內涵豐富的特點。請回答以下問題:
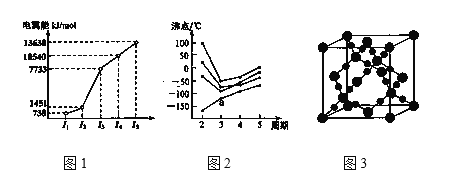
①第三周期的某主族元素,其第一至第五電離能數據如圖1所示,則該元素對應的原子有___種不同運動狀態的電子。
②CO2在高溫高壓下所形成的晶體其晶胞如圖3所示。則該晶體的類型屬于___晶體。
③如圖2所示,每條折線表示周期表ⅣA到ⅦA 中的某一族元素氫化物的沸點變化。每個小黑點代表一種氫化物,其中a點代表的是__。判斷依據___。
【答案】1s22s22p63s23p63d64s2 sp3 極性 在反應過程中,電子從能量較高的軌道遷移到能量較低的軌道,以光的形式釋放能量 Mn2+的3d軌道電子排布為半充滿狀態,較穩定 啞鈴形 sp3 S8、CS2都是非極性分子,根據相似相溶原理知S8易溶于CS2 12 原子晶體 SiH4 第四主族到第七主族的所有元素的氫化物中,只有第四主族的元素氫化物沸點不存在反常現象,且a為第三周期的氫化物,故a為SiH4。
【解析】
由圖標可知a為H,b為Li,c為C,d為N,e為O,f為F,g為Na,h為Mg,i為Al,j為Si,k為S,l為Cl,m為Ar,n為K,據此進行分析。
(1)p為26號元素,根據能量最低原理書寫電子排布式;
(2)根據中心原子N原子的價層電子對數判斷碳原子的雜化方式;
(3)h的單質是Mg,在空氣中燃燒發出耀眼的白光,在反應過程中,電子從能量較高的軌道遷移到能量較低的軌道,以光的形式釋放能量;
(4)由Mn2+轉化為Mn3+時,3d能級由較穩定的3d5半充滿狀態轉變為不穩定的3d4狀態,而Fe2+轉化為Fe3+時,3d能級由不穩定的3d6轉變為較穩定的3d5半充滿狀態;
II.(1)基態S原子核外電子排布式為1s22s22p63s23p4;S原子形成2個S-S鍵,還有2對孤電子對,雜化軌道數為4,S8、CS2都是非極性分子,相似相溶;
(2)①該主族元素第一、第二電離能較小,而第三電離能劇增,說明它容易失去2個電子,最外層有2個電子,又處于第三周期,則為Mg,原子核外沒有運動狀態相同的電子;
②C、O原子之間通過共價鍵形成空間立體網狀結構;
③第四主族到第七主族的所有元素的氫化物中,NH3、H2O、HF的分子之間存在氫鍵,他們的沸點與同主族其它元素的氫化物相比異常的高,圖中a點沒有異常,說明為第四主族的元素的氫化物,a點代表第三周期的氫化物;
(1)p為26號Fe元素,基態原子電子排布式為1s22s22p63s23p63d64s2;
(2)d與a反應的產物NH3,氨氣中氮原子價層電子對數為3+![]() =4,所以N原子的雜化方式為sp3雜化,氮原子的孤對電子數為1,空間結構為不對稱的三角錐形,為極性分子;
=4,所以N原子的雜化方式為sp3雜化,氮原子的孤對電子數為1,空間結構為不對稱的三角錐形,為極性分子;
(3)h的單質是Mg,在空氣中燃燒發出耀眼的白光,在反應過程中,電子從能量較高的軌道遷移到能量較低的軌道,以光的形式釋放能量;
(4)由Mn2+轉化為Mn3+時,3d能級由較穩定的3d5半充滿狀態轉變為不穩定的3d4狀態,需要的能量較多,而Fe2+轉化為Fe3+時,3d能級由不穩定的3d6轉變為較穩定的3d5半充滿狀態需要的能量較少;
II.(1)基態S原子核外電子排布式為1s22s22p63s23p4,最高能級的電子為3p電子,電子云為啞鈴形;S原子形成2個S-S鍵,還有2對孤電子對,雜化軌道數為4,為sp3雜化;S8、CS2都是非極性分子,根據相似相溶原理知S8易溶于CS2;
(2)①該主族元素第一、第二電離能較小,而第三電離能劇增,說明它容易失去2個電子,最外層有2個電子,又處于第三周期,則為Mg,原子核外沒有運動狀態相同的電子,因而共有12中運動狀態不同的電子;
②C、O原子之間通過共價鍵形成空間立體網狀結構,因而該晶體為原子晶體;
③第四主族到第七主族的所有元素的氫化物中,NH3、H2O、HF的分子之間存在氫鍵,他們的沸點與同主族其它元素的氫化物相比異常的高,圖中a點沒有異常,說明為第四主族的元素的氫化物,a點代表第三周期的氫化物,a點代表的是SiH4。


科目:高中化學 來源: 題型:
【題目】在加熱條件下,乙醇轉化為有機物R的過程如圖所示,其中錯誤的是( )
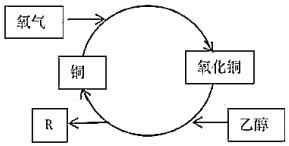
A.R的化學式為C2H4O
B.乙醇發生了氧化反應
C.反應過程中固體有紅黑交替變化的現象
D.乙二醇(HOCH2CH2OH)不能發生類似反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.NO2、SO2、BF3、NCl3分子中沒有一個分子中原子的最外層電子都滿足了8e-穩定結構
B.P4和CH4都是正四面體分子且鍵角都為109o28ˊ
C.NaCl晶體中與每個Na+距離相等且最近的Na+共有12個
D.由原子間通過共價鍵而形成的晶體一定具有高的熔、沸點及硬度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“化學實驗→觀察現象→分析推理→得出結論”是化學學習的方法。下列說法正確的是( )
A.證明某紅棕色氣體是溴蒸氣還是NO2,可用濕潤的淀粉–KI試紙檢驗,觀察試紙顏色變化
B.驗證淀粉的水解產物是否具有還原性,取酸性水解液于試管中并加入新制氫氧化銅懸濁液,加熱煮沸,觀察是否出現磚紅色沉淀
C.向鋁質容器中加入食鹽溶液,再將變黑(Ag2S)的銀器浸入該溶液中,一段時間后發現黑色褪去,該過程中發生的反應為2Al+3Ag2S=6Ag+Al2S3
D.將SO2通入足量稀Fe(NO3)3溶液中,溶液由棕黃色變為淺綠色,但立即又變成棕黃色,假設通入的SO2完全反應,則同溫同壓下,逸出的NO氣體和SO2的體積比為2:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據要求回答下列問題:
I.氯系消毒劑在生活中有廣泛應用。
(1)NaClO2是飲用水的消毒劑,常用FeSO47H2O清除殘留的亞氯酸鈉。
①與SO42-互為等電子體的分子有___(寫一種)。
②ClO2-中氯原子的孤電子對數為___。
③常用K3[Fe(CN)6]檢驗水中的Fe2+。K3[Fe(CN)6]的配體是___。
(2)ClO2是新一代飲用水消毒劑。沸點:ClO2__(填“>”“<”或“=”)Cl2O,理由是___。
Ⅱ.Fe、Cu為過渡金屬元素,它們在工業生產中都有重要的應用。
(1)將乙醇蒸氣通過赤熱的氧化銅粉末,會發生反應:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O
CH3CHO+Cu+H2O
①有同學書寫基態碳原子的核外電子排布圖為![]() ,這樣的書寫不正確,違背了___。
,這樣的書寫不正確,違背了___。
②乙醛和乙醇的相對分子質量相差2,但是乙醇的沸點遠高于乙醛,其主要原因是___。
(2)Fe、Fe2+都能被硝酸氧化。HNO3中氮原子軌道的雜化類型為___。
(3)研究發現,陽離子的顏色與未成對電子數有關。例如Cu2+、Fe2+、Fe3+等。Cu+呈無色,其原因是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】疊氮化鈉(NaN3)是制備醫藥、炸藥的一種重要原料,NaN3易溶于水,微溶于乙醇,易溶于乙醚,水溶液中遇酸放出有毒的HN3;工業上采用“亞硝酸甲酯——水合肼法”制備疊氮化鈉的生產流程如圖:
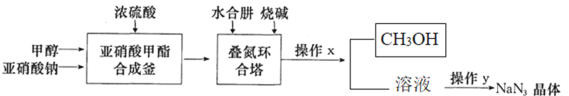
回答下列問題:
(1)寫出亞硝酸甲酯合成釜中生成CH3ONO的化學反應方程式:______。
(2)亞硝酸甲酯以氣體進入疊氮環合塔中生成疊氮化鈉的反應方程式為______。
(3)水合肼(N2H4·H2O)的性質類似一水合氨,與硫酸反應可以生成酸式鹽,該鹽的化學式為______;疊氮環合塔中滴加的燒堿溶液要適當過量,目的是_____;生產流程中操作x的名稱是______。
(4)操作y對溶液加熱蒸發至溶液體積的![]() ,有NaN3晶體析出,洗滌晶體可以用___。
,有NaN3晶體析出,洗滌晶體可以用___。
A.水 B.乙醇 C.乙醇水溶液 D.乙醚
該生產過程中可循環使用的物質是_______。
(5)生產中有HN3生成,請設計實驗證明HN3為弱酸:_______。
(6)化工生產中,多余的NaN3常使用次氯酸鈉溶液處理,在酸性條件下,二者反應可生成無毒的氣體。若處理6.5 g NaN3,理論上需加入0.5 mol·L-1的NaClO溶液_____mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述不相符合的是( )

A.圖甲表示燃料燃燒反應的能量變化
B.圖乙表示酶催化反應的反應速率隨反應溫度的變化
C.圖丙表示弱電解質在水中建立電離平衡的過程
D.圖丁表示強堿滴定強酸的滴定曲線
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】李克強總理曾在國務院政府工作報告中強調二氧化硫、氮氧化物排放量要下降3%。因此,研究煙氣的脫硝(除NOx)、脫硫(除SO2)技術有著積極的環保意義。
(1)汽車的排氣管上安裝“催化轉化器”,其反應的熱化學方程式為:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50 kJ·mol-1。T℃時,將等物質的量的NO和CO充入容積為2 L的密閉容器中,若溫度和體積不變,反應過程中(0~15 min)NO的物質的量隨時間變化如圖。
2CO2(g)+N2(g) ΔH=-746.50 kJ·mol-1。T℃時,將等物質的量的NO和CO充入容積為2 L的密閉容器中,若溫度和體積不變,反應過程中(0~15 min)NO的物質的量隨時間變化如圖。

①圖中a、b分別表示在相同溫度下,使用質量相同但表面積不同的催化劑時,達到平衡過程中n(NO)的變化曲線,其中表示催化劑表面積較大的曲線是_____(填“a”或“b”)。
②T℃時,15 min時,再向容器中充入CO、CO2各0.2 mol,則平衡將____移動(填“向左”、“向右”或“不”)。
(2)在催化劑作用下,用還原劑[如肼(N2H4)]選擇性地與NOx反應生成N2和H2O。
已知200℃時:Ⅰ.3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1;
II.N2H4(g)+H2(g)=2NH3(g) ΔH2=-41.8 kJ·mol-1。
①寫出肼的電子式______。
②200℃時,肼分解成氮氣和氫氣的熱化學方程式為_______。
③目前,科學家正在研究一種以乙烯作為還原劑的脫硝原理,其脫硝率與溫度、負載率(分子篩中催化劑的質量分數)的關系如圖所示。
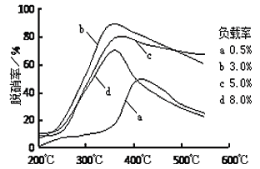
為達到最佳脫硝效果,應采取的條件是_______。
(3)某溫度下,N2O5氣體在一體積固定的容器中發生如下反應:2N2O5(g)=4NO2(g)+O2(g)(慢反應)△H<0,2NO2(g)![]() N2O4(g)(快反應)△H<0,體系的總壓強p總和pO2隨時間的變化如圖所示:
N2O4(g)(快反應)△H<0,體系的總壓強p總和pO2隨時間的變化如圖所示:
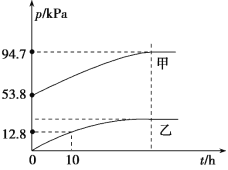
①圖中表示O2壓強變化的曲線是_______(填“甲”或“乙”)。
②已知N2O5分解的反應速率v=0.12pN2O5(kPah-1),t=10 h時,pN2O5=__kPa,v=__kPah-1(結果保留兩位小數,下同)。
③該溫度下2NO2![]() N2O4反應的平衡常數Kp=___kPa-1(Kp為以分壓表示的平衡常數)。
N2O4反應的平衡常數Kp=___kPa-1(Kp為以分壓表示的平衡常數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在1L0.1mol·L-1的NaHCO3溶液中,下列關系式正確
A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
B.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
C.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com