
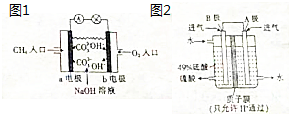
 碳和硫的化合物在生產和生活中的應用非常廣泛,清潔能源的開發、煤的綜合利用等是實驗“低碳生活”、減少空氣污染的重要途徑,試運用所學知識,回答下列問題:
碳和硫的化合物在生產和生活中的應用非常廣泛,清潔能源的開發、煤的綜合利用等是實驗“低碳生活”、減少空氣污染的重要途徑,試運用所學知識,回答下列問題:分析 (1)燃燒熱是指1mol可燃物完全燃燒生成穩定的氧化物時所放出的熱量,此時生成的水必須為液態,利用蓋斯定律來分析;化學反應的實質是舊鍵的斷裂和新鍵的生成;
(2)①燃料電池中,通入燃料的電極是負極,;
②根據電池反應式確定溶液pH變化.
(3)本題為SO2與O2反應生成SO3,SO3再與水化合生成硫酸,根據硫酸的出口判斷正負極,負極發生氧化反應,正極發生還原反應,原電池放電時,電解質溶液中陽離子向正極移動.
解答 解:(1)燃燒熱是指1mol可燃物完全燃燒生成穩定的氧化物時所放出的熱量,此時生成的水必須為液態,已知:
①2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214kJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H2=-566kJ•mol-1
根據蓋斯定律,將$\frac{①+②}{2}$可得:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=$\frac{(-1214KJ/mol)+(-566KJ/mol)}{2}$=-890KJ/mol,即甲烷的熱化學方程式為:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol;
化學反應的實質是舊鍵的斷裂和新鍵的生成,舊鍵的斷裂吸收能量,新鍵的形成放出能量,反應放熱是因為形成新鍵時放出的能量大于斷裂舊鍵時吸收的能量,故答案為:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890KJ/mol;反應中形成新鍵時放出的能量大于斷裂舊鍵時吸收的能量;
(2)①燃料電池中,通入燃料的電極是負極,故答案為:a;
②在堿性溶液中,甲烷燃料電池的總反應式為CH4+2O2+2OH-=CO32-+3H2O,溶液中氫氧根離子被消耗,導致溶液的pH減小,故答案為:減小.
(3)該原電池中,負極上失電子被氧化,所以負極上投放的氣體是二氧化硫,二氧化硫失電子和水反應生成硫酸根離子和氫離子,正極上投放的氣體是氧氣,正極上氧氣得電子和氫離子反應生成水,根據硫酸和水的出口方向知,B極是負極,A極是正極,所以B極上的電極反應式為:SO2-2e-+2H2O═SO42-+4H+,
故答案為:SO2-2e-+2H2O═SO42-+4H+;
點評 本題考查熱化學反應方程式的書寫、原電池原理,注意原電池放電時,電解質溶液pH的變化情況,為易錯點.


科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向NaCl、NaBr、NaI混合溶液中通入F2:I-、Br-、Cl- | |
| B. | 向NaCl、NaI、Na2S混合溶液中滴加AgNO3溶液:S2-、I-、Cl- | |
| C. | 向FeCl3、CuCl2、HCl混合溶液中加入Zn粉:Cu2+、Fe3+、H+ | |
| D. | 向NaAlO2、Na2CO2、NaOH混合溶液中滴加稀鹽酸:AlO2-、CO32-、HCO3-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHSO4(熔融)═Na++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | CH3COOH?CH3COO-+H+ | D. | H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

| 離子 | 開始沉淀時的pH | 完全沉淀時的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com