
| A. | 2個 | B. | 3個 | C. | 4個 | D. | 5個 |
分析 ①注意區分單質和化合物的概念;
②把握極性鍵是形成于不同種原子之間的共價鍵.
③NaHS04固體中只含鈉離子和HSO4-.
④同主族元素的原子序數相差的是2、8、8、18、18、32、32這幾個數字的一個或幾個的連續的加和.
⑤過渡元素包括七個副族和一個第ⅤⅢ族.
⑥I2升華是物理變化,只破壞了分子間作用力.
解答 解:①單質是由同種元素組成的純凈物,而HD中的H和D都是氫原子,都屬于氫元素,故是單質,故①錯誤;
②極性鍵是形成于不同種原子之間的共價鍵,故不同元素組成的多原子分子里的化學鍵一定含極性鍵,但不一定都是極性鍵,故③錯誤;
③NaHS04固體中只含鈉離子和HSO4-,故12g NaHS04固體即0.1mol NaHS04中含0.2mol離子,即陰陽離子總數為0.2NA,故④錯誤;
④同主族元素的原子序數相差的是2、8、8、18、18、32、32這幾個數字的一個或幾個的連續的加和,故可相差2、8、16、26、36、50,故⑤正確;
⑤七個副族和一個第ⅤⅢ族合稱過渡元素,故⑥錯誤;
⑥I2升華是物理變化,只破壞了分子間作用力,故⑦正確.
故不正確的數目為4,
故選C.
點評 本題考查了單質化合物的概念、極性鍵的形成、過渡元素的范圍等等內容,考查范圍廣,綜合性強,難度適中.


科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3溶液中:2c(H2CO3)+c(HCO3-)+c(H+)=c(OH-) | |
| B. | 該沉淀轉化反應的平衡常數約為25 | |
| C. | 約有0.04 mol BaSO4溶解 | |
| D. | 反應后溶液中:c(Na+)>c (CO32-)>c(SO42-)>c(Ba2+) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 物質的溶解過程,實質上就是其電離過程 | |
| B. | 二氧化硫的水溶液能導電,所以二氧化硫是電解質 | |
| C. | 1L0.1 mol•L-1的H2SO4溶液中含有0.2 molH+ | |
| D. | 1L0.1 mol•L-1的H2SO3溶液中含有0.2 molH+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Z、Y、X、W的原子半徑依次減小 | |
| B. | W與X形成的化合物中只含離子鍵 | |
| C. | W的氣態氫化物的沸點一定高于Z的氣態氫化物的沸點 | |
| D. | 若X?Y?W組成的簡單離子電子層結構相同,則W離子半徑最大. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
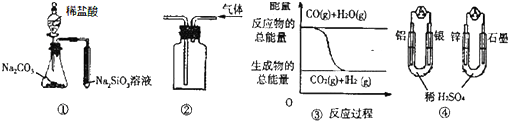
| A. | 用圖 ①所示實驗可比較氯、碳、硅三種元素的非金屬性強弱 | |
| B. | 用圖 ②所示實驗裝置排空氣法收集CO2氣體 | |
| C. | 圖 ③表示反應 CO(g)+H2O(g)?CO2(g)+H2(g)是放熱反應 | |
| D. | 圖 ④兩個裝置中通過導線的電子數相同時,消耗負極材料的物質的量也相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 如圖為某溫度下,CuS(s)、ZnS(s)、FeS(s)分別在溶液中達到沉淀溶解平衡后,溶液中S2-濃度,金屬陽離子濃度變化情況.如果向含有這三種沉淀的混合物中加鹽酸,最先溶解的是FeS.
如圖為某溫度下,CuS(s)、ZnS(s)、FeS(s)分別在溶液中達到沉淀溶解平衡后,溶液中S2-濃度,金屬陽離子濃度變化情況.如果向含有這三種沉淀的混合物中加鹽酸,最先溶解的是FeS.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若某鈉鹽溶液含甲電離出的陰離子,則該溶液既可能與酸反應又可能與堿反應 | |
| B. | 若乙與氧氣的摩爾質量相同,則乙只能由2種元素組成 | |
| C. | 若丙中含有第2周期ⅣA族的元素,則丙可能是甲烷的同系物 | |
| D. | 若丁中各元素質量比跟甲中各元素質量比相同,則丁中一定含有-1價的元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 全部由非金屬元素組成的化合物中只含共價鍵 | |
| B. | 同一主族元素的單質熔點從上到下依次升高 | |
| C. | 某種元素的相對原子質量取整數,就是其質量數 | |
| D. | 第ⅦA族元素的陰離子還原性隨著原子序數的遞增逐漸增強 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com