
某些金屬及金屬氧化物對H2O2的分解反應具有催化作用,請回答下列問題: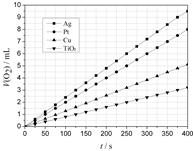
(1)已知:2H2O2(aq) =" 2" H2O (l) + O2(g) 的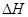 < 0, 則該反應的逆反應能否自發進行? (填“能”或“不能”),判斷依據是 。
< 0, 則該反應的逆反應能否自發進行? (填“能”或“不能”),判斷依據是 。
(2)某同學選用Ag、Pt、Cu、TiO2作為催化劑,在25℃ 時,保持其它實驗條件相同,測得生成的O2體積(V)。V與分解時間(t)的關系如圖所示(O2的體積已折算成標準狀況),則:在不同催化劑存在下,H2O2分解反應的活化能大小順序是 Ea( ) > Ea( ) > Ea( ) > Ea( ) (括號內填寫催化劑的化學式)金屬Pt 催化下,H2O2分解的反應速率v(O2) = mol·s-1
(3)為研究溫度對H2O2分解速率的影響(不加催化劑),可將一定濃度和體積的H2O2置于密閉容器中,在某溫度下,經過一定的時間t,測定生成O2的體積V。然后保持其它初始條件不變,改變溫度T,重復上述實驗。獲得V(O2) ~ T關系曲線。下列趨勢圖最可能符合實測V(O2) ~ T關系曲線的是 ,原因是 。
| A. | B. | C. | D. (4)以Pt為電極電解H2O2也可產生氧氣,寫出H2O2水溶液電解過程中的電極反應式(已知:H2O2的氧化性及還原性均比H2O強):陰極;陽極 。 |
(1)不能 (1分)
逆反應的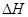 > 0,
> 0,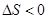 ,因此在任何溫度下都不能自發進行 (2分)
,因此在任何溫度下都不能自發進行 (2分)
(2)①Ea(TiO2) > Ea(Cu) > Ea(Pt) > Ea(Ag) (2分)
② 8.9×10-7 (2分)
(3)C (2分)
因該反應是不可逆反應,不考慮溫度對平衡移動的影響。溫度升高反應速率加快,因而經過相同反應時間后測得的O2體積隨溫度升高而增大 (2分)
(4)H2O2 + 2H+ + 2e- = 2H2O (2分,其它合理答案也給分)
H2O2 - 2e- = O2↑ + 2H+ (2分,其它合理答案也給分)
解析試題分析:
(1)該反應的逆反應是吸熱的反應,并且還是熵減的方向,因此不能自發進行;逆反應的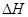 > 0,
> 0,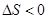 ,因此在任何溫度下都不能自發進行
,因此在任何溫度下都不能自發進行
(2)①從圖上可以看出,在同一個時間點上,二氧化鈦分解生成的氧氣的量少,銅、鉑、銀依次增多,因此有:Ea(TiO2) > Ea(Cu) > Ea(Pt) > Ea(Ag)
② 反應速率是間位時間內濃度的變化量:8.9×10-7
(3)這個反應不是可逆反應,這個很重要,不考慮溫度對平衡移動的影響。溫度升高反應速率加快,因而經過相同反應時間后測得的O2體積隨溫度升高而增大。
(4)H2O2的氧化性及還原性均比H2O強,因此在兩極得失電子都是雙氧水了:
陰極:H2O2 + 2H+ + 2e- = 2H2O
陽極:H2O2 - 2e- = O2↑ + 2H+
考點:化學反應速率、化學反應的方向以及電化學。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
如圖所示的裝置中發生反應2A2(g)+B2(g)2C(g);△H=" -a" kJ/mol(a >0),已知P是可自由滑動的活塞。在相同溫度時關閉K,向A, B容器中分別充入2mol A2和1mol B2兩容器分別在500℃時達平衡,A中C的濃度為w1 mol/L,放出熱量 b kJ,B中C的濃度為w2 mol/L,放出熱量 c kJ。請回答下列問題:
(1)此反應的平衡常數表達式為______________________;若將溫度升高到700℃,反應的平衡常數將_____________(增大、減小或不變)。
(2)比較大小:w1_____ w2(填>、=、<),a、b、c由大到小的關系 ______________________。
(3)若打開K,一段時間后重新達平衡,容器B的體積將______________________(填增大,減小或不變)。
(4)若讓A,B體積相等且固定P,在B中改充入4mol A2和2mol B2,在500℃時達平衡后C 的濃度為w3 mol/L,則 w1,w3的關系______________________。
(5)能說明A中已達到平衡狀態的是 (填序號,有一個或多個選項符合題意)。
a、v(C)=2v(B2)
b、容器內氣體壓強保持不變
c、容器中氣體的平均相對分子質量不隨時間而變化
d、容器內的氣體密度保持不變
(6)使該反應的反應速率增大,且平衡向正反應方向移動的是_____________。
a、及時分離出C氣體 b、適當升高溫度
c、增大B2的濃度 d、選擇高效的催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
把大氣中的游離態的氮轉化為氮的化合物的過程稱為固氮。生物固氮和大氣固氮(閃電時N2轉化為NO)屬于自然固氮,這遠不能滿足人類的需要。工業固氮(合成氨)是目前人工固氮的主要方法。有關大氣固氮和工業固氮的平衡常數K值分別如下表一和表二。
表一:N2+ O2  2NO
2NO
| 溫度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
 2NH3
2NH3 | 溫度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |
 2NO是吸熱反應
2NO是吸熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
KI溶液在酸性條件下能與氧氣反應。現有以下實驗記錄:
| 實驗編號 | ① | ② | ③ | ④ | ⑤ |
| 溫度(℃) | 30 | 40 | 50 | 60 | 70 |
| 顯色時間(s) | 160 | 80 | 40 | 20 | 10 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(9分)已知:2SO2(g)+O2(g) 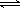 2SO3(g);△H=-196 kJ/mo1,850K時,在2L固定容積的密閉容器中充入2mol SO2和2mol O2,10分鐘后達到平衡,SO2濃度和時間關系如圖。
2SO3(g);△H=-196 kJ/mo1,850K時,在2L固定容積的密閉容器中充入2mol SO2和2mol O2,10分鐘后達到平衡,SO2濃度和時間關系如圖。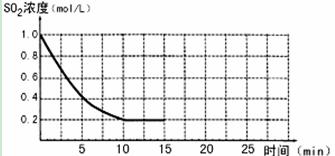
回答下列問題
(1)前10分鐘內O2的平均反應速率為 mol/(L·min)
(2)平衡時,02的轉化率為 ,此時反應共放熱 kJ。
(3)若15分鐘時維持溫度不變,壓縮容器體積,使其體積變為1L,假設在20分鐘時達到新平衡,此時c(O2)=1.15 mol/L,請在圖上畫出15-25分鐘SO2的濃度變化曲線。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氨氣是生產氮肥、硝酸、純堿等的重要原料。
(1)實驗室模擬合成氨。在恒溫恒容密閉容器中按照甲、乙、丙三種方式分別投料(單位是mol /L),平衡時測得甲容器中H2的轉化率為20%。
| | N2 | H2 | NH3 |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
 CO(NH2)2 (l) + H2O (l),該反應的平衡常數和溫度關系如下:
CO(NH2)2 (l) + H2O (l),該反應的平衡常數和溫度關系如下:| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
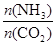 =x,下圖是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是 。
=x,下圖是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是 。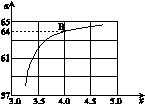
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
反應aA(g)+bB(g) cC(g)(△H<0)在等容條件下進行。改變其他反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質濃度隨時間變化的曲線如下圖所示:
cC(g)(△H<0)在等容條件下進行。改變其他反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質濃度隨時間變化的曲線如下圖所示: 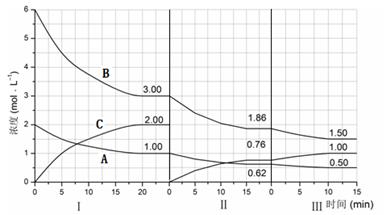
回答問題:
(1)反應的化學方程式中,a:b:c為 ;
(2)B的平衡轉化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最大的是 ,其值是 ;
(3)由第一次平衡到第二次平衡,平衡移動的方向是 ,采取的措施是 ;
(4)比較第Ⅱ階段反應溫度(T2)和第Ⅲ階段反應溫度(T3)的高低:T2 T3 (填“<”、“>或“=”),判斷的理由是 ;
(5)達到第三次平衡后,將容器的體積擴大一倍,假定10min后達到新的平衡,請在下圖中用曲線表示第IV階段體系中B物質的濃度隨時間變化的趨勢(注:只須畫出B的濃度隨時間變化曲線)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
合成氨工業對國民經濟和社會發展具有重要的意義。其原理為: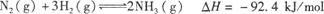 ,據此回答以下問題:
,據此回答以下問題:
(1)①該反應的化學平衡常數表達式為K= 。
②根據溫度對化學平衡的影響規律可知,對于該反應,溫度越高,其平衡常數的值越 。
(2)某溫度下,若把10 mol N2與30 mol H2置于體積為10 L的密閉容器內,反應達到平衡狀態時,測得混合氣體中氨的體積分數為20%,則該溫度下反應的K= (可用分數表示)。
能說明該反應達到化學平衡狀態的是 (填字母)。
a.容器內的密度保持不變 b.容器內壓強保持不變
c.v正(N2)=2v逆(NH3) d.混合氣體中c(NH3)不變
(3)對于合成氨反應而言,下列有關圖像一定正確的是(選填序號) 。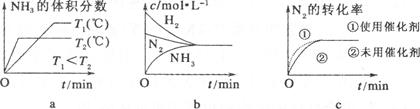
(4)相同溫度下,有恒容密閉容器A和恒壓密閉容器B,兩容器中均充入1 mol N2和3 mol H2,此時兩容器的體積相等。在一定條件下反應達到平衡狀態,A中NH3的體積分數為a,放出熱量Q1kJ;B中NH3的體積分數為b,放出熱量Q2kJ。則:a b(填“>”、“<”或“=”,下同),Q1 Q2,Q1 92.4。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)25 ℃時,合成氨反應的熱化學方程式為:N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
①在該溫度時,取l mol N2和3 mol H2放在密閉容器中,在催化劑存在下進行反應,測得反應放出的熱量總是_______92.4 kJ。(填“小于”, “大于” 或“等于”)
②一定條件下,上述可逆反應在體積固定的密閉容器中進行,下列敘述能說明反應已達到平衡的是_______________。
| A.NH3生成的速率與NH3分解的速率相等 |
B.混合氣體的反應速率 v正(NH3)=v逆(H2) v正(NH3)=v逆(H2) |
| C.容器內的密度不再變化 |
| D.單位時間內消耗a mol N2,同時生成2a mol NH3 |
 值將_____(填“增大”, “減小” 或“不變”)。
值將_____(填“增大”, “減小” 或“不變”)。查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com