
有45.45 g KClO3和MnO2的混合物,加熱一段時間后,質量變為40.65 g.將此剩余固體平均分成兩份。?
(1)一份加足量的水溶解后,過濾,在濾液中加足量的硝酸酸化了的AgNO3溶液,可得沉淀多少克??
(2)另一份加入足量的濃鹽酸,加熱使之反應.將放出的氣體通入含KI、KBr的1 L混合溶液,恰好使溶液中Br-、I-完全反應.若KI的物質的量濃度與KBr的物質的量濃度相等,都為0.35 mol·L-1,試求KClO3的分解百分率。
(1)7.175 g (2)33%?
差量法是化學計算中的常用方法之一。減輕的質量即為生成的氧氣的質量。據此可計算出生成的KCl質量,即求出AgCl沉淀的量。?
(1)混合物加熱后質量減輕45.45-40.65=4.8 g,即生成O2的質量為4.8 g,混合物的一半可產生2.4 g O2。?
設分解了KClO3 x mol,生成KCly mol,生成沉淀z g。
2KClO3![]() 2KCl +3O2↑
2KCl +3O2↑
2 mol 2 mol 96 g?
x mol ?y mol 2.4 g
x=y=0.05?
KCl+AgNO3 = AgCl↓+KNO3?
1 mol 143.5 g?
0.05 mol z mol
z=7.175 g?
(2)由于KBr、KI的物質的量均為:0.35 mol·L-1×1 L=0.35 mol
Cl2 + 2KBr = 2KCl+Br2?
1 2?
n(Cl2) 0.35
n(Cl2)=0.175 mol?
即另一半固體混合物與濃鹽酸反應,共放出0.35 mol Cl2?
6HCl+KClO3![]() KCl+3Cl2↑+3H2O?
KCl+3Cl2↑+3H2O?
122.5 g 3 mol?
m g ![]() mol
mol
4HCl+MnO2![]() MnCl2+Cl2↑+2H2O?
MnCl2+Cl2↑+2H2O?
87 g 1 mol?
w g ![]() mol
mol

解得![]() 則KClO3的分解率=
則KClO3的分解率=![]() ×100%=33%.
×100%=33%.


 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案 開心蛙口算題卡系列答案
開心蛙口算題卡系列答案科目:高中化學 來源: 題型:閱讀理解
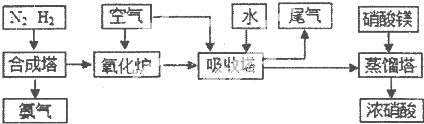
| A | B | C | D | E | |
| n(CO2) | 3 | l | 0 | 1 | l |
| n(H2) | 2 | l | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | l |
| T/°C | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源:四川省攀枝花市2012-2013學年高一下學期期末調研監測化學試題 題型:022
(1)在200℃、101 kPa時,1 g H2與碘蒸氣完全反應放出7.45 kJ的熱量,請寫出該反應的熱化學方程式________.
(2)在1×105 Pa和298 K時,將拆開1 mol共價鍵所需要的能量稱為鍵能(kJ/mol).下面是一些共價鍵的鍵能:
在298 K時,在催化劑存在下,H2(g)+Cl2(g)=2HCl(g) ΔH=________kJ/mol
(3)已知:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-116 kJ·mol-1
CH3OH(g) ΔH1=-116 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH2=-283 kJ·mol-1
O2(g)=CO2(g) ΔH2=-283 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
O2(g)=H2O(g) ΔH3=-242 kJ·mol-1
則表示1 mol氣態甲醇完全燃燒生成CO2和水蒸氣時的熱化學方程式為:
________.
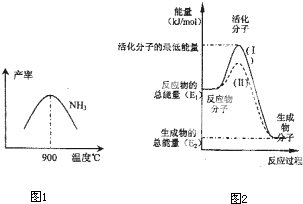
(4)N2(g)+3H2(g)![]() 2NH3(g)反應過程的能量變化如圖所示.已知2 mol N2(g)反應生成4 mol NH3(g)放出-188.4 kJ/mol.則:
2NH3(g)反應過程的能量變化如圖所示.已知2 mol N2(g)反應生成4 mol NH3(g)放出-188.4 kJ/mol.則:

圖中E的大小對該反應的反應熱有無影響?________.(填“有影響”或“無影響”).該反應通常用鐵觸媒作催化劑,加鐵觸媒會使圖中B點升高還是降低?________(填“升高”或“降低”).圖中ΔH=________kJ/mol.對于達平衡后的該反應,若只改變下列條件之一,能使單位體積內活化分子百分數增加的是________.
A.升溫
B.再充入N2和H2,并使它們的濃度都增加一倍
C.減壓
D.加催化劑
查看答案和解析>>
科目:高中化學 來源:2012-2013學年北京市通州區高三年級上學期期末摸底考試化學試卷(解析版) 題型:選擇題
下列說法正確的是
A.2 mol/L KCl溶液與1 mol/L K2SO4溶液混合后,c(K+)為2 mol/L
B.120 g NaCl溶液中溶有20 g NaCl,該溫度下NaCl的溶解度為20g
C.22.4 L HCl氣體溶于水制成1 L溶液,該溶液的物質的量濃度為1 mo1/L
D.把5 g膽礬(CuSO4∙5H2O)溶于45 g水中,所得溶液溶質的質量分數為10%
查看答案和解析>>
科目:高中化學 來源:2011-2012學年高三上學期單元測試(6)化學試卷(新人教版) 題型:實驗題
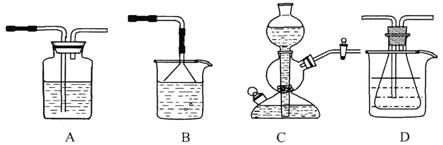
(10分)我國化工專家侯德榜的“侯氏制堿法”曾為世界制堿工業做出了突出貢獻。他利用NaHCO3、NaCl、NH4C1等物質溶解度的差異,以食鹽、氨氣、二氧化碳等為原料制得NaHCO3,進而生產出純堿。以下A、B、C、D四個裝置可組裝成實驗室模擬 “侯氏制堿法”制取NaHCO3的實驗裝置。裝置中分別盛有以下試劑:B:稀硫酸;C:鹽酸、碳酸鈣;D:含氨的飽和食鹽水、水
四種鹽在不同溫度下的溶解度(g/100g水)表
|
|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36_3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
—① |
— |
— |
— |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
|
|
NH4Cl |
29.4 |
33.3 |
37.2[來源:Z|xx|k.Com] |
41.4 |
45.8[來源:Z*xx*k.Com] |
50.4 |
55.3 |
77.3 |
(說明:①>35℃NH4HCO3會有分解)
請回答以下問題:
(1)裝置的連接順序應是 (填字母)。
(2)A裝置中盛放的試劑是 ,其作用是 。
(3)在實驗過程中,需要控制D溫度在30℃~35℃,原因是 。
(4)反應結束后,將錐形瓶浸在冷水中,析出NaHCO3晶體。用蒸餾水洗滌NaHCO3晶體的目的是除去 雜質(以化學式表示)
(5)將錐形瓶中的產物過濾后,所得的母液中含有 (以化學式表示),加入氯化氫,并進行 操作,使NaCl溶液循環使用,同時可回收NH4C1。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com