
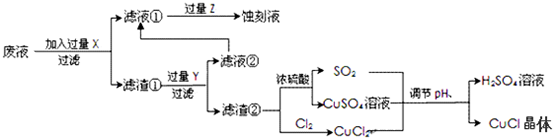
分析 要利用制作印刷電路的廢液制備氯化亞銅,首先應制備并分離出銅,向工業上以制作印刷電路的廢液(含Fe3+、Cu2+、Fe2+、Cl-)加入過量的鐵粉,三價鐵離子與鐵粉反應轉化為二價鐵離子,銅離子與鐵反應生成銅,然后過濾,濾渣為過量的鐵和生成的銅,依據銅與鐵活潑性,將濾渣溶于鹽酸,銅與鹽酸不反應,過濾得到濾渣即為銅,然后銅與濃硫酸反應生成硫酸銅和二氧化硫,銅與氯氣反應生成氯化銅,硫酸銅、二氧化硫、氯化銅反應生成氯化亞銅;
(1)工業生產硫酸的方法為接觸法制硫酸,氯堿工業的裝置是離子交換膜電解槽;
(2)印刷電路的廢液(含Fe3+、Cu2+、Fe2+、Cl-)加入鐵,三價鐵離子能夠原鐵反應生成二價鐵離子,銅離子能夠與鐵反應生成銅;過濾后濾渣中含有銅和鐵,依據銅和鐵的活潑性,加入鹽酸分離二者;
(3)依據圖示可知:CuCl2、CuSO4、SO2、H2O反應生成H2SO4、CuCl,依據得失電子守恒配平方程式;
(4)抽濾或者減壓過濾可以快速過濾,CuCl是一種白色粉末,微溶于水、不溶于乙醇及稀硫酸,乙醇洗滌可以減少CuCl的損失,生產過程中調節溶液的pH不能過大是防止其水解生成沉淀;
(5)依據圖示可知:銅與濃硫酸反應生成硫酸銅、二氧化硫的物質的量之比為1:1,而產生CuCl的化學方程式中硫酸銅、二氧化硫物質的量之比恰好為:1:1;
(6)依據氯化亞銅具有還原性,易被氧化而變質,具有見光分解的性質解答.
解答 解:向工業上以制作印刷電路的廢液(含Fe3+、Cu2+、Fe2+、Cl-)加入過量的鐵粉,三價鐵離子與鐵粉反應轉化為二價鐵離子,銅離子與鐵反應生成銅,然后過濾,濾渣為過量的鐵和生成的銅,依據銅與鐵活潑性,將濾渣溶于鹽酸,銅與鹽酸不反應,過濾得到濾渣即為銅,然后銅與濃硫酸反應生成硫酸銅和二氧化硫,銅與氯氣反應生成氯化銅,硫酸銅、二氧化硫、氯化銅反應生成氯化亞銅;
(1)工業生產硫酸的方法名稱是接觸室,氯堿工業的裝置是離子交換膜電解槽,
故答案為:接觸室,離子交換膜電解槽;
(2)印刷電路的廢液(含Fe3+、Cu2+、Fe2+、Cl-)加入鐵,三價鐵離子能夠原鐵反應生成二價鐵離子,銅離子能夠與鐵反應生成銅,過濾后濾渣中含有銅和鐵,加入鹽酸,鐵與鹽酸反應生成氯化亞鐵,銅與鹽酸不反應,將銅分離出來,
故答案為:Fe;HCl;
(3)依據圖示可知:CuCl2、CuSO4、SO2、H2O反應生成H2SO4、CuCl,產生CuCl的化學方程式依據得失電子守恒得到:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4,
故答案為:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4;
(4)生產中為了提高CuCl產品的質量,采用抽濾或者減壓過濾法快速過濾,析出的CuCl晶體不用水而用無水乙醇洗滌的目的是減少CuCl的損失,生產過程中調節溶液的pH不能過大的原因是防止CuCl水解;
故答案為:抽濾或者減壓過濾,減少CuCl的損失,防止CuCl水解;
(5)依據圖示可知:Cu+2 H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反應中生成的CuSO4和 SO2為1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反應中消耗CuSO4和SO2也為1﹕1,所以理論上不需要補充SO2氣體,
故答案為:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O反應中生成的CuSO4和 SO2為1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反應中消耗CuSO4和SO2也為1﹕1,所以理論上不需要補充SO2氣體;
(6)氯化亞銅具有還原性,易被氧化而變質,具有見光分解,所以生產中應防止CuCl的氧化和見光分解,減少產品CuCl的損失,
故答案為:防止CuCl的氧化和見光分解.
點評 本題為工藝流程題,為高考熱點和難點,設計物質的分離、物質的制備,明確物質的性質是解題關鍵,注意物質性質的理解應用,題目難度較大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
| 第一電離能 | 離子半徑 | 熔點 | 酸性 |
| P>S | O2->Na+ | CaO<MgO | HClO4>H2SO4 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高二上月考一化學試卷(解析版) 題型:選擇題
把4 mol A氣體和4 mol B氣體混合放入2 L的恒容密閉容器中,在一定條件下發生反應:2A(g)+2B(g) 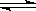 C(g)+2D(g);經5min達到平衡, 測得壓強減小了10%,下列說法中正確的是
C(g)+2D(g);經5min達到平衡, 測得壓強減小了10%,下列說法中正確的是
A.平衡體系中C的體積分數為1/9
B.平衡時A的濃度為2.4mol/L
C.D的平均速率為0.32mol/(L·min)
D.B的轉化率為20%
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省高二上月考一化學卷(解析版) 題型:選擇題
已知:2H2(g)+O2(g)===2H2O(l);ΔH=-571.6 kJ·mol-1
CO(g)+ O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1
O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1
現有CO、H2和CO2組成的混合氣體112.0 L(標準狀況)完全燃燒后放出的總熱量為851.4 kJ,并生成18 g液態水。則燃燒前混合氣體中CO的體積分數為
A.80% B.40% C.60% D.20%
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
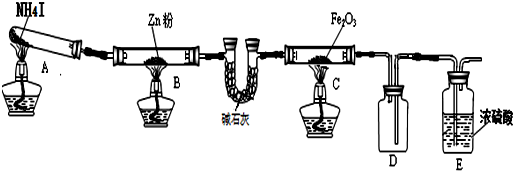
| 步驟 | 操作 | 甲組現象 | 乙組現象 |
| 1 | 取黑色粉末加入稀鹽酸 | 溶解,無氣泡 | 溶解,有氣泡 |
| 2 | 取步驟1中溶液,滴加KSCN溶液 | 變紅 | 無明顯變化 |
| 3 | 向步驟2溶液中滴加新制氯水 | 紅色先變深后褪去 | 先變紅后也褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 沉淀物 | 開始沉淀時的pH | 完全沉淀時的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 淀粉和纖維素的相對分子質量相同,互稱同分異構體 | |
| B. | 糖類、油脂、蛋白質都屬于天然高分子化合物 | |
| C. | 油脂在酸性條件下和堿性條件下都可以水解,且水解產物均相同 | |
| D. | 在允許加熱的條件下,可以用氫氧化銅鑒別葡萄糖、乙酸、乙醇 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙酸乙酯中 | B. | 乙酸中 | ||
| C. | 水中 | D. | 乙酸、乙酸乙酯和水中 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com