
【題目】氮氧化合物是目前造成大氣污染的主要氣體,而汽車尾氣中就含有NO 等多種污染氣體。汽車尾氣里含有的NO氣體是由于內燃機燃燒的高溫引起氮氣和氧氣反應所致。請結合所學知識回答下列問題:
(1) 已知:N2(g)+2O2(g)![]() 2NO2(g) △H1=+67.8 kJ/mol
2NO2(g) △H1=+67.8 kJ/mol
2NO2(g)![]() O2(g)+2NO(g) △H2=+116.2 kJ/mol
O2(g)+2NO(g) △H2=+116.2 kJ/mol
則N2(g)+O2(g)![]() 2NO(g) △H=_________kJ/mol;汽車啟動后,氣缸溫度越高,單位時間內NO 的排放量越大,分析其原因為_____________
2NO(g) △H=_________kJ/mol;汽車啟動后,氣缸溫度越高,單位時間內NO 的排放量越大,分析其原因為_____________
(2) 若反應N2(g)+O2(g)![]() 2NO(g)是在恒容條件下進行,下列能說明該反應已達到平衡狀態的是________
2NO(g)是在恒容條件下進行,下列能說明該反應已達到平衡狀態的是________
a.2υ正(N2)= υ逆(NO) b.混合氣體密度不變
c.生成1molO2的同時生成2molNO d.混合氣體平均相對分子質量不變
(3) 汽車尾氣凈化反應:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.5 kJ/mol,若將0.20molNO和0.10molCO充入一個容積恒定為1L 的密閉容器中,在不同條件下,反應過程中部分物質的濃度變化狀況如圖所示:
N2(g)+2CO2(g) △H= -746.5 kJ/mol,若將0.20molNO和0.10molCO充入一個容積恒定為1L 的密閉容器中,在不同條件下,反應過程中部分物質的濃度變化狀況如圖所示:
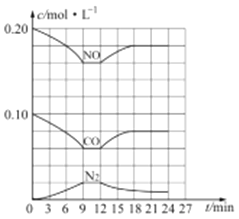
①該反應能自發進行的條件為_____ (填“高溫”、“低溫”或“任意溫度”);
②在6~9 min 內,以CO 表示的平均反應速率 υ(CO)=________mol·L-l·min-1;
③第12min時改變的反應條件為_________ (填“升高溫度”或“降低溫度”);
④反應在第24min時的平衡常數K=____________(只列出計算式,無需計算結果),若保持溫度不變,再向容器中充入CO、N2 各0.060mol,平衡將_________移動(填“正向”、“逆向”或“不”)。
【答案】 +184.0 溫度升高,反應速率加快;且溫度升高有利于平衡正向移動 ac 低溫 0.0067 升高溫度 ![]() 逆向
逆向
【解析】試題分析:本題考查蓋斯定律的應用、化學平衡的標志、化學平衡圖像的分析、外界條件對化學反應速率和化學平衡的影響、化學反應速率和化學平衡常數的計算、化學反應自發性的判斷。
(1)對反應編號,N2(g)+2O2(g)![]() 2NO2(g)△H1=+67.8kJ/mol(①式)
2NO2(g)△H1=+67.8kJ/mol(①式)
2NO2(g)![]() O2(g)+2NO(g)△H2=+116.2kJ/mol(②式)
O2(g)+2NO(g)△H2=+116.2kJ/mol(②式)
應用蓋斯定律,將①式+②式得,N2(g)+O2(g)![]() 2NO(g)△H=ΔH1+ΔH2=(+67.8kJ/mol)+(+116.2kJ/mol)=+184.0kJ/mol。汽車啟動后,氣缸溫度越高,單位時間內NO的排放量越大,其原因是:溫度升高,反應速率加快;且溫度升高有利于平衡正向移動。
2NO(g)△H=ΔH1+ΔH2=(+67.8kJ/mol)+(+116.2kJ/mol)=+184.0kJ/mol。汽車啟動后,氣缸溫度越高,單位時間內NO的排放量越大,其原因是:溫度升高,反應速率加快;且溫度升高有利于平衡正向移動。
(2)a項,2υ正(N2)=υ逆(NO)表示正、逆反應速率相等,能說明反應已達到平衡狀態;b項,根據質量守恒定律,混合氣體的總質量始終不變,在恒容容器中,混合氣體的密度始終不變,混合氣體的密度不變不能說明反應已達到平衡狀態;c項,生成1molO2一定消耗2molNO,生成1molO2的同時生成2molNO,說明各物質的濃度保持不變,能說明反應已達到平衡狀態;d項,根據質量守恒定律,混合氣體的總質量始終不變,該反應反應前后氣體分子數不變,建立平衡過程中氣體分子總物質的量始終不變,混合氣體平均相對分子質量始終不變,混合氣體平均相對分子質量不變不能說明反應已達到平衡狀態;能說明反應已達到平衡狀態的是ac,答案選ac。
(3)①反應2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的ΔH=-746.5kJ/mol
N2(g)+2CO2(g)的ΔH=-746.5kJ/mol![]() 0、ΔS
0、ΔS![]() 0,該反應能自發進行時ΔG=ΔH-TΔS
0,該反應能自發進行時ΔG=ΔH-TΔS![]() 0,可見該反應自發進行的條件為低溫。
0,可見該反應自發進行的條件為低溫。
②根據圖像6~9min內,υ(CO)=![]() =0.0067mol/(L·min)。
=0.0067mol/(L·min)。
③根據圖像,第12min時改變條件,達到新平衡時N2濃度減小,NO、CO的濃度增大,改變條件平衡向逆反應方向移動,由于該反應的正反應為放熱反應,所以改變的條件為升高溫度。
④根據圖像,結合三段式
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
c(起始)(mol/L) 0.2 0.1 0 0
c(轉化)(mol/L) 0.02 0.02 0.01 0.02
c(24min)(mol/L) 0.18 0.08 0.01 0.02
24min時反應達到平衡狀態,反應的平衡常數K=![]() =
=![]() =0.01929。若保持溫度不變,再向容器中充入CO、N2各0.060mol,此時NO、CO、N2、CO2物質的量濃度依次為0.18mol/L、0.14mol/L、0.07mol/L、0.02mol/L,此時的濃度商Qc=
=0.01929。若保持溫度不變,再向容器中充入CO、N2各0.060mol,此時NO、CO、N2、CO2物質的量濃度依次為0.18mol/L、0.14mol/L、0.07mol/L、0.02mol/L,此時的濃度商Qc=![]() =0.044
=0.044![]() 0.01929,平衡將逆向移動。
0.01929,平衡將逆向移動。


 勵耘書業暑假銜接寧波出版社系列答案
勵耘書業暑假銜接寧波出版社系列答案科目:高中化學 來源: 題型:
【題目】給你提供純鋅、純銅片和500 mL 0.4 mol·L-1的H2SO4溶液、導線、1000 mL量筒。試用下圖裝置來測定鋅和稀硫酸反應時在某段時間內通過導線的電子的物質的量。

(1)如圖所示,裝置氣密性良好,且1 000 mL量筒中已充滿了水,則開始實驗時,首先要______。
(2)a電極材料為________,其電極反應式為______________。b電極材料為________,其電極反應式為______________。
(3) 當量筒中收集672 mL氣體時(已折算到標準狀況下),通過導線的電子的物質的量為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據實驗室制備氯氣的裝置(如下),回答下列問題;

(1)儀器A 和 B名稱___________ ;____________
(2)寫出B中發生反應的離子方程式_____________________________________
(3)裝置C的作用__________________________________________
(4)裝置D的作用________________________________________________
(5)檢驗E中氯氣已經收集滿的方法_________________________________________
(6)寫出F中發生的反應方程式______________________________________________
(7)每生成0.5mol氯氣轉移________________個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Co(H2PO2)2廣泛用于化學鍍鈷,以金屬Co和NaH2PO2為原料,采用四室電滲析槽電解法制備,原理如圖。下列敘述正確的是

A. b為陽離子交換膜
B. 通電后原料室的H2PO2向產品室遷移,陰極區溶液pH增大
C. 石墨電極反應為4OH4e![]() O2↑+2H2O
O2↑+2H2O
D. 當產生1 mol Co(H2PO2)2時,產生標準狀況下氣體11.2 L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第三周期元素X、Y、Z、W的最高價氧化物溶于水可得四種溶液,0.01mol/L的這四種溶液pH與該元素原子半徑的關系如下圖所示。下列說法正確的是

A. 簡單離子半徑: X>Y>Z>W
B. W的單質在常溫下是黃綠色氣體
C. 氣態氫化物的穩定性: Z>W>Y
D. X和Y的最高價氧化物對應的水化物恰好中和時,溶液中的微粒共有2種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Hf元素有多種核素,其中Hf是一種新合成的核素。下列關于![]() 的敘述中不正確的是( )
的敘述中不正確的是( )
A.該核素的質子數是72B.該核素的中子數是113
C.該核素的核外電子數是72D.該元素的相對原子質量是185
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、Z、W、R在元素周期表中的相對位置如圖所示,其中R元素的常見單質為氣體,下列判斷不正確的是( )

A.原子半徑:Z>X> Y
B.非金屬性:R>W> Z
C.X、Z對應的含氧酸均為強酸
D.Y的最簡單氫化物的沸點比X的高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)鈉米材料二氧化鈦(TiO2)具有很高的化學活性,可做性能優良的催化劑。工業上二氧化鈦的制備是:
資料卡片 | ||
物質 | 熔點 | 沸點 |
SiCl4 | -70℃ | 57.6℃ |
TiCl4 | -25℃ | 136.5℃ |
I. 將干燥后的金紅石(主要成分TiO2,主要雜質SiO2)與碳粉混合裝入氯化爐中,在高溫下通入Cl2反應制得混有SiCl4雜質的TiCl4。
II. 將SiCl4分離,得到純凈的TiCl4。
III. 在TiCl4中加水、加熱,水解得到沉淀TiO2·xH2O。
IV. TiO2·xH 2O高溫分解得到TiO2。
①TiCl4與SiCl4在常溫下的狀態是________。II中所采取的操作名稱是_______。
②III中反應的化學方程式是____________________________________________。
③如IV在實驗室完成,應將TiO2·xH2O放在________(填儀器編號)中加熱。

(2)根據廢水中所含有害物質的不同,工業上有多種廢水的處理方法。

①廢水I若采用CO2處理,離子方程式是________________。
②廢水Ⅱ常用明礬處理。實踐中發現廢水中的c(HCO![]() )越大,凈水效果越好,這是因為______________。
)越大,凈水效果越好,這是因為______________。
③廢水III中的汞元素存在如下轉化(在空格上填相應的化學式):Hg2++______=CH3Hg++H+,我國規定,Hg2+的排放標準不能超過0.05 mg/L。若某工廠排放的廢水1 L中含Hg2+ 3×10-7mo1,是否達到了排放標準__(填“是”或“否”)。
④廢水Ⅳ常用C12氧化CN—成CO2和N2,若參加反應的C12 與CN-的物質的量之比為5︰2,則該反應的離子方程式為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“酒是陳的香”,就是因為酒在儲存過程中生成了有香味的乙酸乙酯,在實驗室我們也可以用如圖所示的裝置制取乙酸乙酯。

回答下列問題:
(1)寫出制取乙酸乙酯的化學反應方程式_______________________________。
(2)濃硫酸的作用是___________________與吸水劑。
(3)飽和碳酸鈉溶液的主要作用是_________________________________________________。
(4)裝置中通蒸氣的導管要插在飽和碳酸鈉溶液的液面上,不能插入溶液中,目的是防止__________________。
(5)若要把制得的乙酸乙酯分離出來,應采用的實驗操作是_______________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com