
【題目】下列事實不能用勒夏特列原理來解釋的是
A.用排飽和食鹽水的方法收集氯氣
B.合成氨工業選擇高溫
C.開啟啤酒瓶后,瓶中馬上泛起大量泡沫
D.在Fe3++3SCN-![]() Fe(SCN)3反應達平衡時,增加KSCN的濃度,體系顏色變深
Fe(SCN)3反應達平衡時,增加KSCN的濃度,體系顏色變深
【答案】B
【解析】
勒夏特列原理即平衡移動原理是如果改變影響平衡的一個條件(如濃度、壓強或溫度等),平衡就向能夠減弱這種改變的方向移動,平衡移動原理適用的對象應存在可逆過程,如與可逆過程無關,則不能用平衡移動原理解釋。
A. Cl2+H2O![]() H++Cl-+HClO,用排飽和食鹽水的方法收集氯氣,飽和食鹽水中氯離子濃度大,平衡逆向移動,降低氯氣的溶解度,能用勒夏特列原理解釋;
H++Cl-+HClO,用排飽和食鹽水的方法收集氯氣,飽和食鹽水中氯離子濃度大,平衡逆向移動,降低氯氣的溶解度,能用勒夏特列原理解釋;
B. 合成氨工業選擇高溫,主要考慮催化劑的活性最大,不能用勒夏特列原理解釋;
C. 開啟啤酒瓶后,瓶中馬上泛起大量泡沫,是壓強減小,H2CO3![]() H2O+CO2正向移動,能用勒夏特列原理解釋;
H2O+CO2正向移動,能用勒夏特列原理解釋;
D. 在Fe3++3SCN-![]() Fe(SCN)3反應達平衡時,增加KSCN的濃度,平衡正向移動,體系顏色變深,能用勒夏特列原理解釋;
Fe(SCN)3反應達平衡時,增加KSCN的濃度,平衡正向移動,體系顏色變深,能用勒夏特列原理解釋;
故選B。


 智慧小復習系列答案
智慧小復習系列答案科目:高中化學 來源: 題型:
【題目】將氣體A、B置于固定容積為2 L的密閉容器中,發生如下反應:3A(g)+B(g)2C(g)+2D(g),反應進行到10 s末,達到平衡,測得A的物質的量為1.8 mol,B的物質的量為0.6 mol,C的物質的量為0.8 mol。
(1)用C表示10 s內反應的平均反應速率為________。
(2)反應前A的物質的量濃度是________。
(3)10 s末,生成物D的濃度為________。
(4)A與B的平衡轉化率之比為________。
(5)反應過程中容器內氣體的平均相對分子質量變化是________(填“增大”、“減小”或“不變”,下同),氣體的密度變化是________。
(6)平衡后,若改變下列條件,生成D的速率如何變化(填“增大”、“減小”或“不變”):①降低溫度______;②增大A的濃度________;③恒容下充入氖氣_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應N2+3H2![]() 2NH3的正、逆反應速率可用各反應物或生成物濃度的變化來表示。下列各關系中能說明反應已達到平衡狀態的是( )
2NH3的正、逆反應速率可用各反應物或生成物濃度的變化來表示。下列各關系中能說明反應已達到平衡狀態的是( )
A. 3v正(N2)=v正(H2)B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤燃燒產生的煙氣中含有SO2和NOx,用NaOH、NaClO、Ca(ClO)2等溶液作為吸收劑可同時對煙氣進行脫硫、脫硝。
(1)下列關于吸收SO2過程發生的有關反應,用下列方程式表示:
①SO2(g)+2OH-(aq)=SO![]() (aq)+H2O(l) k1
(aq)+H2O(l) k1
②ClO-(aq)+SO![]() (aq)=SO
(aq)=SO![]() (aq)+Cl-(aq) k2
(aq)+Cl-(aq) k2
③CaSO4(s)=Ca2+(aq)+SO![]() (aq) k3
(aq) k3
k1、k2、k3分別表示反應①、②、③的化學平衡常數,則反應:SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的化學平衡常數K=___(用k1、k2、k3表示)。
(2)標準狀況下,把SO2通入11.2mL水中制得飽和溶液,測得其pH=0.74。已知:標準狀況下SO2在水中的溶解度按體積比為1:67.2(即V(H2O):V(SO2)=1:67.2)。
①寫出該溶液中存在的電離平衡___。
②已知飽和溶液中的SO2有![]() 與水反應生成H2SO3,求H2SO3的第一步電離平衡常數Ka1=___(已知lg1.8≈0.26,忽略第二步電離和溶液體積的變化,結果用科學計數法表示,保留2位有效數字)。
與水反應生成H2SO3,求H2SO3的第一步電離平衡常數Ka1=___(已知lg1.8≈0.26,忽略第二步電離和溶液體積的變化,結果用科學計數法表示,保留2位有效數字)。
(3)SO2的水溶液中存在歧化反應:3SO2+2H2O=2H2SO4+S↓,I-可作為該反應的催化劑,催化過程如下:
a:SO2+4I-+4H+=S↓+2I2+2H2Ob:I2+2H2O+SO2=SO42-+2I-+4H+
欲探究反應a和b的反應速率與歧化反應的速率的關系,設計實驗如下:將18mLSO2的水溶液分別加入2mL下列試劑中,密閉放置,觀察現象。(已知I2易溶于KI溶液,溶液呈棕褐色)
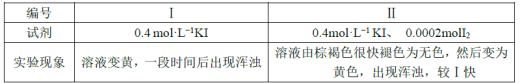
完成下列問題:
①由實驗現象可得出反應a與反應b的速率:v(a)___v(b)(填“>”“﹤”或“=”)。
②測得反應3SO2+2H2O=2H2SO4+S↓在實驗Ⅰ中,部分物質的物質的量的變化如圖所示(設混合溶液的體積為兩溶液的體積之和):則曲線N表示___(填物質的名稱)的變化。該反應在實驗Ⅰ條件下進行,15min時達到化學平衡狀態,用SO2表示該反應前15min內的平均反應速率為___mol·L-1·min-1。

③下列敘述能說明3SO2(aq)+2H2O(l)=2H2SO4(aq)+S(s)反應已達到平衡狀態的是____填字母)。
A.生成1.5molSO2的同時消耗1molH2SO4
B.反應過程中,溶液中的分子總數不再變化
C.恒溫恒容時,混合溶液中硫酸的密度保持不變
D.絕熱恒容時,反應的化學平衡常數不再變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】完成下列問題:
(1)10Be和9Be______________。
a.是同一種原子 b.具有相同的中子數
c.具有相同的化學性質 d.具有相同的核外電子排布
(2)有下列微粒或物質:
①![]() O、
O、![]() O、
O、![]() O ②H2O、D2O ③石墨、金剛石 ④H2、D2、T2 ⑤H、D、T ⑥
O ②H2O、D2O ③石墨、金剛石 ④H2、D2、T2 ⑤H、D、T ⑥![]() K、
K、![]() Ca、
Ca、![]() Ar,回答下列問題:
Ar,回答下列問題:
a.互為同位素的是______________;
b.互為同素異形體的是______________;
c.由①和⑤中的微粒能結合成水,可得水分子的種數為__________種;可得相對分子質量不同的水分子種數為__________種,相對分子質量最大的是____________(寫化學式)。
(3)![]() H2
H2![]() O的摩爾質量為____________,相同質量的
O的摩爾質量為____________,相同質量的![]() H2
H2![]() O與
O與![]() H2
H2![]() O所含質子數之比為______,中子數之比為__________。
O所含質子數之比為______,中子數之比為__________。
(4)電解相同質量的![]() H2
H2![]() O和
O和![]() H2
H2![]() O時產生的氫氣在同溫同壓下體積之比為__________,質量之比為__________。
O時產生的氫氣在同溫同壓下體積之比為__________,質量之比為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家研發出一種新型水溶液鋰電池,采用復合膜包裹的金屬鋰作負極,錳酸鋰(LiMn2O4)作正極,以0.5 mol/Li2SO4 水溶液作電解質溶液。電池充、放電時,LiMn2O4與Li2Mn2O4可以相互轉化。下列有關該電池的說法正確的是

A. 該電池放電時,溶液中的SO42-向電極b移動
B. 該電池負極的電極反應式為:2Li+2H2O==2LiOH+H2↑
C. 電池充電時,外加直流電源的正極與電極a相連
D. 電池充電時,陽極的電極反應式為:Li2Mn2O4-e-==LiMn2O4 +Li+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸亞鐵晶體(FeC2O4·2H2O)是一種黃色難溶于水的固體,受熱易分解,是生產電池、涂料以及感光材料的原材料。為探究純凈草酸亞鐵晶體熱分解的產物,設計裝置圖如下:
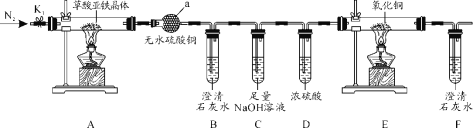
(1)儀器a的名稱是______。
(2)從綠色化學考慮,該套裝置存在的明顯缺陷是_________。
(3)實驗前先通入一段時間N2,其目的為__________。
(4)實驗證明了氣體產物中含有CO,依據的實驗現象為_______。
(5)草酸亞鐵晶體在空氣易被氧化,檢驗草酸亞鐵晶體是否氧化變質的實驗操作是____。
(6)稱取5.40g草酸亞鐵晶體用熱重法對其進行熱分解,得到剩余固體質量隨溫度變化的曲線如下圖所示:
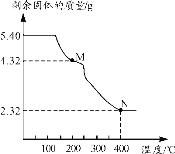
①上圖中M點對應物質的化學式為_________。
②已知400℃時,剩余固體是鐵的一種氧化物,試通過計算寫出M→N發生反應的化學方程式:_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中不正確的是( )
A.SiO2(s)+2C(s)=Si(s)+2CO(g)只能在高溫下自發進行,則該反應ΔH<0
B.在外加電流的陰極保護法中,海上石油鋼鐵鉆井平臺與直流電源的負極相連
C.25℃時0.1mol·L-1CH3COONa溶液加水稀釋后,溶液中![]() 的值減小
的值減小
D.“氧陰極還原法”制取H2O2的反應為2H2O+O2![]() 2H2O2。反應中每消耗2.24LO2(標準狀況下),轉移的電子數目為0.4×6.02×l023
2H2O2。反應中每消耗2.24LO2(標準狀況下),轉移的電子數目為0.4×6.02×l023
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一固定容積的密閉容器中進行著如下反應:CO2(g)+H2(g)![]() CO(g) +H2O(g)其平衡常數K和溫度t的關系如下:
CO(g) +H2O(g)其平衡常數K和溫度t的關系如下:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表達式為:___;
(2)該反應的正反應為__反應(“吸熱”或“放熱”);
(3)當溫度為850℃,某時刻測得該溫度下的密閉容器中各物質的物質的量見表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此時上述的反應中正、逆反應速率的關系式是__(填代號)。
A.υ(正)>υ(逆) B.υ(正)<υ(逆) C.υ(正)=υ(逆) D.無法判斷
(4)在700℃通過壓縮體積增大氣體壓強,則該反應中H2(g)的轉化率___(“增大”、“減小”或“不變”);工業生產中,通過此方法使容器內氣體壓強增大以加快反應,卻意外發現H2(g)的轉化率也顯著提高,請你從平衡原理解釋其原因___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com