
(12分)X、Y、Z、W是四種短周期元素,X原子M層上的電子數是原子核外電子層數的2倍;Y原子最外層電子數是次外層電子數的2倍;Z元素的單質為雙原子分子,Z的氫化物水溶液呈堿性;W元素最高正價是+7價。回答下列問題:
(1)元素X的氫化物的電子 式為___________
式為___________
(2)元素Y的一種中子數為8的同位素可測定文物年代,這種同位素的符號是______________。
(3)元素Z能與氫元素形成+1價陽離子,該陽離子粒子符號是_________________。
(4)元素W的單質與元素X的低價氧化物在水溶液中反應的離子方程式為_____________________。
(5)ZW3常溫下呈液態,可與水反應生成一種弱酸和一種弱堿,反應的化學方程式為__ ________ 。
(6)探尋物質的性質差異性是學習的重要方法之一,X、Y、Z、W四種元素的最高價氧化物的水化物中化學性質明顯不同于其他三種酸的是_____________(用酸的化學式表示)。
 全能練考卷系列答案
全能練考卷系列答案科目:高中化學 來源:2015-2016學年山西省高一上期中考試化學試卷(解析版) 題型:選擇題
將質量分數為a%,物質的量濃度為c1 mol/L的稀H2SO4蒸發掉一定量的水,使之質量分數變為2a%,此時物質的量濃度為c2 mol/L,則c1和 c2的數值關系是
A. c2﹥2 c1 B. c2﹤c1 C. c2=c1 D.無法確定
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高一上第一次月考化學試卷(解析版) 題型:填空題
(1)若NA為阿伏伽德羅常數,則3.4g氨氣中所含氫原子個數為 。
(2)約3.01×1023個OH-的質量為 g,含有電子的物質的量為 ,這些OH-與 mol NH3的質量相同。
(3)將4gNaOH固體溶于水配成250mL溶液,此溶液中NaOH的物質的量濃度為_ _mol/L。取出10mL溶液加水稀釋到100mL,稀釋后溶液中NaOH的物質的量濃度為_____________mol/L。
(4)現有M、N兩種氣態化合物,其摩爾質量之比為2:1,試回答下列問題:
①同溫同壓下,M、N氣體的密度之比為____________
②相同溫度下,在兩個相同體積的密閉容器中分別充入M、N,若兩個容器中氣體的密度相等,則兩個容器中的壓強之比為____________
③將M、N兩種氣體分別溶于水(M、N與水均不反應)配成溶液,當兩種溶液的質量分數相同時,其密度分別為d1和d2,則兩種溶液的物質的量濃度之比為____________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年內蒙古奮斗中學高一上9月質檢化學試卷(解析版) 題型:選擇題
300 mL 0.2 mol/L KCl溶液與100 mL 0.3 mol/L AlCl3溶液中Cl-物質的量濃度之比是
A.1∶3 B.2∶3 C.2∶1 D.2∶9
查看答案和解析>>
科目:高中化學 來源:2015-2016學年青海省高二上9月質檢化學試卷(解析版) 題型:選擇題
把鎂條投入到盛有鹽酸的敞口容器中,產生H2的速率下列因素中,①鹽酸的濃度,②鎂條的表面積,③溶液的溫度,④氯離子的濃度,影響反應速率的因素是
A.①④ B.③④ C.①②③ D.②③
查看答案和解析>>
科目:高中化學 來源:2015-2016學年重慶巴蜀中學高一上10月月考化學試卷(解析版) 題型:選擇題
同溫同壓下,xg甲氣體和yg乙氣體占有相同的體積,根據阿伏加德羅定律判斷下列敘述錯誤的是
A.x:y等于甲與乙的相對分子質量之比
B.x:y等于甲與乙的分子個數之比
C.x:y等于同溫同壓下甲與乙的密度之比
D.y:x等于同溫同體積下,等質量的甲與乙的壓強之比
查看答案和解析>>
科目:高中化學 來源:2015-2016學年重慶一中高一上學期10月月考化學試卷(解析版) 題型:選擇題
下列關于蒸發操作的說法正確的是
A.蒸發時,用酒精燈直接將水蒸干以獲得晶體
B.實驗完畢,用坩堝鉗取下蒸發皿于實驗桌上,不能用手觸碰
C.可以加入沸石或碎瓷片代替玻璃棒攪拌
D.蒸發過程中應用玻璃棒不斷攪拌以防止液滴飛濺
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省、宜昌一中高三上10月聯考化學試卷(解析版) 題型:選擇題
滿足分子式為C4H8ClBr的有機物共有
A.11種 B.12種
C.13種 D.14種
查看答案和解析>>
科目:高中化學 來源:2016屆廣東省高三上學期第二次教學質檢化學試卷(解析版) 題型:填空題
(15分)FeCl3 具有凈水作用,但腐蝕設備,而聚合氯化鐵是一種新型的絮凝劑,處理污水比FeCl3 高效,且腐蝕性小。請回答下列問題:
(1)FeCl3 凈水的原理是 。FeCl3 溶液腐蝕鋼鐵設備,除H+作用外,另一主要原因是(用離子方程式表示) 。
(2)為節約成本,工業上用NaClO3 氧化酸性FeCl2 廢液得到FeCl3 。
①若酸性FeCl2 廢液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,則該溶液的PH約為 。
②完成NaClO3 氧化FeCl2 的離子方程式:
 ClO3-+
ClO3-+ Fe2++
Fe2++ =
= Cl-+
Cl-+ Fe3++
Fe3++ .
.
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O 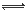 Fe(OH)2++H+——K1
Fe(OH)2++H+——K1
Fe(OH)2++H2O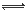 Fe(OH)2++H+——K2
Fe(OH)2++H+——K2
Fe(OH)2++H2O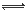 Fe(OH)3+H+——K3
Fe(OH)3+H+——K3
以上水解反應的平衡常數K1、K2、K3由大到小的順序是 。
(4)FeCl3也可以用作SO2尾氣的吸收劑,原理上與NaOH吸收SO2有何不同______________________
(5)電解時,微粒的放電順序遵循微粒得失電子能力的強弱,SO32—具有強的還原性。用NaOH吸收煙氣中的SO2,將所得的Na2SO3溶液用碳棒進行電解,寫出陽極電極反應_____________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com