
新近出版的《前沿科學》雜志刊發的中國環境科學研究院研究員的論文《汽車尾氣污染及其危害》,其中系統地闡述了汽車尾氣排放對大氣環境及人體健康造成的嚴重危害。目前降低尾氣的可行方法是在汽車排氣管上安裝催化轉化器。NO和CO氣體均為汽車尾氣的成分,這兩種氣體在催化轉換器中發生反應:(其中a、b、c均為正值)2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
(1)CO2的電子式為 。
(2)已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃燒熱△H=-c kJ·mol-1。書寫在消除汽車尾氣中NO2的污染時,NO2與CO的可逆反應的熱化學反應方程式 。
(3)在一定溫度下,將2.0mol NO、2.4mol氣體CO通入到固定容積為2L的容器中,反應過程中部分物質的濃度變化如圖所示:
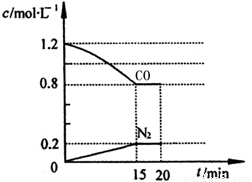
①有害氣體NO的轉化率為 ,0~15min NO的平均速率v(NO)= 。
②20min時,若改變反應條件,導致CO濃度減小,則改變的條件可能是 (選填序號)。
a.縮小容器體積 b.增加CO的量 c.降低溫度 d.擴大容器體積
③若保持反應體系的溫度不變,20min時再向容器中充入NO、N2各0.4mol,化學平衡將 移動(選填“向左”、“向右”或“不”), 移動后在達到平衡時的平衡常數是 。
 考前必練系列答案
考前必練系列答案科目:高中化學 來源:2016-2017學年江蘇省高一上期中化學卷(解析版) 題型:填空題
(1)12.4 g Na2X含有0.4 mol Na+,Na2X的摩爾質量為 ,其相對式量為 ,X的相對原子質量為 ,該物質的化學式為 。
(2)在新制氯水中存在的各種粒子中:(用化學式或離子符號填寫,下同)
①使氯水呈黃綠色的是 ;②能使硝酸銀溶液產生白色沉淀的是 ;
③能使紫色石蕊試液顯紅色的是 ;④能使濕潤的紅紙褪色的是 ;
⑤能使無水硫酸銅變藍的是 ;⑥能與碳酸氫鈉溶液反應放出氣體的是 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省高二上期中必修化學卷(解析版) 題型:選擇題
下列常用于保護食物,以免食物被微生物侵蝕而腐敗的是 ( )
A. MgCl2 B. NaCl C. NaNO2 D.KNO3
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江雙鴨山一中高二上期中化學卷(解析版) 題型:選擇題
對于反應CO(g )+H2O(g)
)+H2O(g) CO2(g)+H2(g) ΔH<0,在其他條件不變的情況下,下列說法正確的是
CO2(g)+H2(g) ΔH<0,在其他條件不變的情況下,下列說法正確的是
A.改變壓強,平衡不發生移動,反應放出的熱 量不變
量不變
B.加入催化劑,改變了反應的途徑,反應的ΔH也隨之改變
C.若在原電池中進行,反應放出的熱量不變
D.升高溫度,反應速率加快,反應放出的熱量不變
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江雙鴨山一中高二上期中化學卷(解析版) 題型:選擇題
把 0.6molX氣體和0.4molY氣體混合于2L的密閉容器中,使它們發生如下反應3X(g) + Y(g)  nZ(g)+2W(g),5min末已生成 0.2molW,若測知以 Z 表示的平均反應速率為 0.01mol·L﹣1·min﹣1,則 n是
nZ(g)+2W(g),5min末已生成 0.2molW,若測知以 Z 表示的平均反應速率為 0.01mol·L﹣1·min﹣1,則 n是
A.1 B.4 C.2 D.3
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江大慶一中高二上11月月考化學卷(解析版) 題型:選擇題
已知25℃時,CaSO4在水中的沉淀溶解平衡曲線如圖所示,向100mL該條件下的CaSO4飽和溶液中,加入400 mL 0.01 mol/L的Na2SO4溶液,針對此過程的下列敘述正確的是
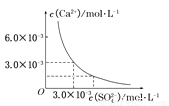
A.溶液中析出CaSO4固體沉淀,最終溶液中c(SO42-)較原來大
B.溶液中無沉淀析出,溶液中c(Ca2+)、c(SO42-)都變小
C.溶液中析出CaSO4固體沉淀,溶液中c(Ca2+)、c(SO42-)都變小
D.溶液中無沉淀析出,但最終溶液中c(SO42-)較原來大
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江大慶一中高二上11月月考化學卷(解析版) 題型:選擇題
0.1mol/LNa2S溶液,下列說法正確的是
A.c(Na+)=2c(S2-) B.c(OH-)=c(H+)+c(HS-)+2c(H2S)
C.c(Na+)>c(S2-)> c(HS-)>c(OH-) D.c(Na+)+ c(H+)=c(OH-)+c(HS-)+c(S2-)
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高一上期中化學試卷(解析版) 題型:選擇題
只給出下列甲中和乙中對應的量,不能組成一個求物質的量的公式的是

A.③ B.③④ C.②③④ D.③④⑤
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高二上11月月考化學卷(解析版) 題型:填空題
已知在25℃的水溶液中,AgX、AgY、AgZ均難溶于水,但存在溶解平衡.當達到平衡時,溶液中離子濃度的乘積是一個常數(此常數用Ksp表示,Ksp和水的KW相似).如:
AgX(s) Ag+(aq)+X-(aq);Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
Ag+(aq)+X-(aq);Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
AgY(s) Ag+(aq)+Y-(aq);Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
Ag+(aq)+Y-(aq);Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
AgZ(s) Ag+(aq)+Z-(aq);Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
Ag+(aq)+Z-(aq);Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
(1)根據以上信息,判斷AgX、AgY、AgZ三者的溶解度(用已被溶解的溶質的物質的量/1 L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小順序為 。
(2)若向AgY的飽和溶液中加入少量的AgX固體,則c(Y-) (填“增大”、“減小”或“不變”)。
(3)在25℃時,若取0.188 g的AgY(相對分子質量為188)固體放入100 mL水中(忽略溶液體積的變化),則溶液中Y-的物質的量濃度為 。
(4)①由上述Ksp判斷,在上述(3)的體系中,能否實現AgY向AgZ的轉化,并簡述理由: ②在上述(3)體系中,能否實現AgY向AgX的轉化?根據你的觀點選答一項.若不能,請簡述理由: ,若能,則實驗轉化的必要條件是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com