
 工業上和凈化后的水煤氣在催化劑作用下,與水蒸氣發生反應制取氫氣,化學方程式為:CO(g)+H2O(g)?H2(g)+CO2(g).一定條件下,將4molCO與2molH2O(g)充入體積為2L的密閉容器中,體系中各物質的深度隨時間變化如圖所示:
工業上和凈化后的水煤氣在催化劑作用下,與水蒸氣發生反應制取氫氣,化學方程式為:CO(g)+H2O(g)?H2(g)+CO2(g).一定條件下,將4molCO與2molH2O(g)充入體積為2L的密閉容器中,體系中各物質的深度隨時間變化如圖所示:分析 (1)圖象分析可知4min反應達到平衡狀態,物質濃度為c(CO)=1.2mol/L,c(H2)=0.8mol/L,c(H2O)=0.2mol/L,結合化學平衡三段式列式計算平衡濃度,反應速率V=$\frac{△c}{△t}$,平衡常數K=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$;
(2)依據(1)的計算結果得到轉化率=$\frac{消耗量}{起始量}$×100%;
(3)若6min時改變的外部條件為升溫,圖象可知氫氣濃度減小,一氧化碳和水的濃度增大,說明平衡逆向進行,依據化學平衡移動原理分析;
(4)平衡標志是正逆反應速率相同,各組分含量保持不變,反應過程中“變量不變”分析選項;
(5)計算濃度商和平衡常數比較大小分析判斷反應進行的方向,濃度商大于平衡常數正向進行,小于平衡常數逆向進行;
解答 解:(1)圖象分析可知4min反應達到平衡狀態,物質濃度為c(CO)=1.2mol/L,c(H2)=0.8mol/L,c(H2O)=0.2mol/L,結合化學平衡三段式列式計算平衡濃度,
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L) 2 1 0 0
變化量(mol/L) 0.8 0.8 0.8 0.8
平衡量(mol/L) 1.2 0.2 0.8 0.8
在0~4min時段,反應速率v(H2O)=$\frac{△c}{△t}$=$\frac{0.8mol/L}{4min}$=0.2mol/(L•min),
平衡常數K=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$=$\frac{0.8×0.8}{1.2×0.2}$=2.7;
故答案為:0.2mol/(L•min);2.7;
(2)該反應到4min時,CO的轉化率=$\frac{0.8mol/L}{2mol/L}$×100%=40%;
故答案為:40%;
(3)若6min時改變的外部條件為升溫,圖象可知氫氣濃度減小,一氧化碳和水的濃度增大,說明平衡逆向進行,逆向為吸熱反應,正反應為放熱反應,則該反應的△H<0,此時平衡逆向進行,平衡常數減小;
故答案為:<,減小;
(4)上述分析可知,反應CO(g)+H2O(g)?H2(g)+CO2(g)是氣體體積不變的放熱反應
a.反應前后氣體質量和體積不變,混合氣體的密度始終不變,不能說明反應達到平衡狀態,故a錯誤;
b.混合氣體中c(CO)不變是平衡的標志,故b正確;
c.v(H2O)正=v(H2)正,反應速率之比等于化學方程式計量數之比,為正反應速率之比,只能說明反應正向進行,不能證明正逆反應速率相同,故c錯誤;
d.斷裂2molH-O鍵的同時生成1molH-H鍵,說明反應正向進行,不能這么說明正逆反應速率相同,故d錯誤;
故答案為:b;
(5)若保持與4min時相同的溫度,向一容積可變的密閉容器中同時充入0.5molCO、1.5molH2O(g)、0.5molCO2和amolH2,則當a=2.5時,Q=$\frac{2.5×0.5}{0.5×1.5}$=1.7<K=2.7,說明反應正向進行;若要使上述反應開始時向逆反應進行,Q=$\frac{a×0.5}{0.5×1.5}$>2.7,則a的取值范圍為a>4.05;
故答案為:正反應;a>4.05.
點評 本題考查了化學平衡的分析應用,主要是圖象分析,平衡常數、反應速率的概念計算應用,注意一下化學平衡的因素分析判斷,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:填空題
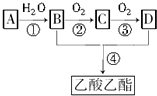 已知:①A是石油裂解氣的主要成分,A的產量通常用來衡量一個國家的石油化工水平;
已知:①A是石油裂解氣的主要成分,A的產量通常用來衡量一個國家的石油化工水平;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
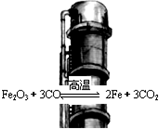
| A. | 升高溫度,反應速率減慢 | |
| B. | 當反應達到化學平衡時,υ(正)=υ(逆)=0 | |
| C. | 提高煉鐵高爐的高度可減少尾氣中CO的濃度 | |
| D. | 某溫度下達到平衡時,CO的體積分數基本不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KAl(SO4)2 | B. | NH4Al(SO4)2 | C. | (NH4)2Fe(SO4)2 | D. | NH4Fe(SO4)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 陽離子 | NH4+、K+、Al3+、Mg2+ |
| 陰離子 | HCO3-、Cl-、MnO4-、SO42- |
| A. | 肯定沒有Mg2+、HCO3-、Cl-、MnO4- | |
| B. | 一定含有K+,且c(K+)=2mol/L | |
| C. | 該溶液可能是KAl(SO4)2和NH4Al(SO4)2的混合溶液 | |
| D. | 若僅根據實驗③,將該溶液蒸干、灼燒,有可能得到僅含有氧化鋁固體物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 非金屬元素的原子最外層電子數都大于或等于4 | |
| B. | 只有非金屬能形成含氧酸或含氧酸鹽 | |
| C. | Na2O2中陰陽離子的個數比為1:1 | |
| D. | 非金屬元素組成的化合物不一定是共價化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增加體系的壓強 | B. | 減少C的物質的量濃度 | ||
| C. | 增加A的物質的量 | D. | 升高體系的溫度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
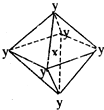 在某晶體中,與某一種微粒x距離最近且等距離的另一種微粒y所圍成的空間構型為正八面體型(如圖).該晶體可能為( )
在某晶體中,與某一種微粒x距離最近且等距離的另一種微粒y所圍成的空間構型為正八面體型(如圖).該晶體可能為( )| A. | NaCl | B. | CsCl | C. | CO2 | D. | SiO2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com