
【題目】實驗室以一種工業廢渣(主要成分為MgCO3、Mg2SiO4和少量Fe、Al的氧化物)為原料制備MgCO3·3H2O。實驗過程如下:

(1)酸溶過程中主要反應的熱化學方程式為
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)="==2" Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1
酸溶需加熱的目的是______;所加H2SO4不宜過量太多的原因是_______。
(2)加入H2O2氧化時發生發應的離子方程式為___________。
(3)用右圖所示的實驗裝置進行萃取分液,以除去溶液中的Fe3+。

①實驗裝置圖中儀器A的名稱為_______。
②為使Fe3+盡可能多地從水相轉移至有機相,采取的操作:向裝有水溶液的儀器A中加入一定量的有機萃取劑,______、靜置、分液,并重復多次。
(4)請補充完整由萃取后得到的水溶液制備MgCO3·3H2O的實驗方案:邊攪拌邊向溶液中滴加氨水,______,過濾、用水洗滌固體2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知該溶液中pH=8.5時Mg(OH)2開始沉淀;pH=5.0時Al(OH)3沉淀完全]。
【答案】(1)加快酸溶速率;避免制備MgCO3時消耗更多的堿
(2)H2O2+2Fe2++2+=2Fe3++2H2O (3)①分液漏斗;②充分振蕩
(4)至5.0<pH<8.5,過濾,邊攪拌邊向濾液中滴加Na2CO3溶液至有大量沉淀生成,靜置,向
上層清液中滴加Na2CO3溶液,若無沉淀生成,
【解析】
試題(1)加熱可以加快化學反應速率;如果硫酸過多,則需要消耗更多的減中和硫酸,從而造成生產成本增加。(或影響Mg2+轉化成MgCO3。)
(2)濾液中含有Fe2+,加入H2O2將Fe2+氧化為Fe3+,發生發應的離子方程式為H2O2+2Fe2++2H+===2Fe3++2H2O。
(3)①根據儀器A的構造確定其名稱為分液漏斗。②為使Fe3+盡可能多地從水相轉移至有機相,采取的操作:向裝有水溶液的儀器A中加入一定量的有機萃取劑,充分振蕩、靜置、分液,并重復多次。
(4)根據題給信息知向溶液中加入氨水調節pH不大于8.5,不小于5.0,故由萃取后得到的水溶液制備MgCO3·3H2O的實驗方案:邊攪拌邊向溶液中滴加氨水,至5.0<pH<8.5,過濾,邊攪拌邊向濾液中滴加Na2CO3溶液至有大量沉淀生成,靜置,向上層清液中滴加Na2CO3溶液,若無沉淀生成或至5.0<pH<8.5,過濾,邊攪拌邊向濾液中滴加Na2CO3溶液至無沉淀生成為止,過濾、用水洗滌固體2~3次,在50℃下干燥,得到MgCO3·3H2O。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】兩種物質互為同分異構體的依據是( )
A.二者具有相似的化學性質B.二者分子式相同但分子內碳原子的結合方式不同
C.二者具有相同的空間結構D.二者具有相同的物理性質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)鋁土礦(主要成分為Al2O3,還含有SiO2(不溶于水和酸)、Fe2O3)是工業上制備氧化鋁的主要原料。工業上提取氧化鋁的工藝流程如下:

①沉淀 A、B的成分分別是____________、____________;步驟②中的試劑a是_________;(以上均填化學式)。
②試寫出步驟③中發生反應的離子方式______________、________________;
③簡述檢驗所得濾液甲中存在Fe3+的操作方法:________________________。
(2)用含少量鐵的氧化銅制取氯化銅晶體(CuCl2·xH2O)。有如下操作:

已知:在pH為4~5時,Fe3+幾乎完全轉化為Fe(OH)3沉淀,Cu2+卻不反應。
①加熱酸溶過程中發生反應的化學方程式有:_______________________。
②氧化劑A可選用_________________(填編號,下同)。
A.KMnO4 B.HNO3 C.Cl2
③要得到較純的產品,試劑B可選用____________________。
A. NaOH B. CuO C.FeO
④試劑B的作用是_______________________________。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀 C. 降低溶液的pH D. 提高溶液的pH
⑤從濾液經過結晶得到氯化銅晶體的方法是_________(按實驗先后順序選填編號)。
A. 過濾 B. 蒸發至干 C. 冷卻 D. 蒸發濃縮
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨基甲酸銨(H2 NCOONH4)是一種易分解、易水解的白色固體。其研究小組以濃氨水、干冰等為原料制備氨基甲酸銨的實驗裝置如圖1所示,其主要反應的原理為2NH3(g)+CO2(g)![]() NH2COONH4(s) △H<0
NH2COONH4(s) △H<0


(1)儀器1的名稱是___________。儀器3中盛裝的固體是___________,其作用是___________。
(2)儀器6的一個作用是控制原料氣按反應計量系數充分反應,若反應初期觀察到裝置內濃硫酸中產生氣泡,則應該___________(填“加快”“減慢”或“不改變”)產生氨氣的速率。
(3)另一種制備氨基甲酸銨的反應裝置(液體石蠟和CCl4均充當惰性介質)如圖2所示。
①液體石蠟鼓泡瓶的作用是______________________。
②若無冰水,則氨基甲酸銨易分解生成尿素[CO(NH2)2]請寫出氨基甲酸銨受熱分解的化學方程式:______________________。
③當CCl4液體中產生較多晶體懸浮物時,立即停止反應,過濾分離得到粗產品,為了將所得粗產品干燥,可采取的方法是___________(填標號)。
A.蒸餾 B.真空微熱烘干 C.高壓加熱烘干
(4)制得的氨基甲酸銨中可能含有碳酸氫銨、碳酸銨中的一種或兩種雜質(不考慮氨基甲酸銨與水的反應)。
①設計方案,進行成分探究,請填寫表中空格。
限選試劑:蒸餾水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、稀鹽酸。
實驗步驟 | 預期現象和結論 |
步驟1:取少量固體樣品于試管中,加入蒸餾水至固體溶解 | 得到無色溶液 |
步驟2:向試管中加入過量的BaCl2溶液,靜置 | 若溶液不變渾濁,則證明固體中不含碳酸銨 |
步驟3:向試管中繼續加入___________ | ___________,則證明固體中含有碳酸氫銨 |
②根據①的結論。取15.8g氨基甲酸銨樣品,用足量氧氧化鋇溶液充分處理后,過濾、洗滌、干燥,測得沉淀質量為1.97g。則樣品中氨基甲酸銨的質量分數為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】歸納總結是學習化學的一種方法。
(1)甲同學發現A、B、C三種物質有如圖l所示的相互反應關系,“—”表示能反應(部分反應物、生成物以及反應條件省略,下同)。己知A是常見金屬,人體缺乏組成A的元素易患貧血癥;B胃酸的主要成分;B與C反應產生不溶于稀硝酸的白色沉淀,則A是__(填化學式(下同),C是___。請寫出下列反應的化學方程式:A與B__;B與C____。

(2)乙同學發現X、Y、Z三種物質有如圖2所示的循環轉化關系“→”表示能轉化。
①若X、Y、Z均為含鈣化合物,X是一種常用干燥劑氯化鈣,Y俗稱熟石灰。則X的化學式為___;請寫出Y→Z的反應化學方程式____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用50 mL0.50 mol/L鹽酸與50 mL 0.55 mol/L NaOH溶液,在如圖所示的裝置中進行中和反應。測定強酸與強堿反應的反應熱。

起始溫度t1/℃ | 終止溫度 t2/℃ | 溫度差 (t2-t1) /℃ | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)從實驗裝置上看,圖中尚缺少的一種玻璃儀器是 _________。
(2)裝置中大、小燒杯之間填滿碎泡沫塑料的目的是______________________________。
(3)某同學實驗記錄的數據如上表所示,其中記錄的終止溫度是指______________溫度。
(4)大燒杯上如不蓋硬紙板,求得的中和熱數值_________(填“偏大”、“偏小”、“無影響”)。
(5)計算該實驗發生中和反應時放出的熱量為________________kJ(中和后生成的溶液的比熱容c=4.18J/(g·℃ ) (保留兩位小數)。
(6)如果用50 mL0.55mol/L的氨水(NH3·H2O)代替NaOH溶液進行上述實驗,通過測得的反應熱計算中和熱,則△H會_________(填“偏大”、“偏小”、“無影響”),其原因是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組用下圖裝置進行SO2 與FeCl3溶液反應的相關實驗(夾持裝置已略去)。

(1)配制氯化鐵溶液時,需先把氯化鐵晶體溶解在鹽酸中,再加水稀釋,這樣操作的目的是___。
(2)通入足量SO2時,裝置C中觀察到的現象為_______________。
(3)根據以上現象,該小組同學認為SO2 與 FeCl3溶液發生氧化還原反應。
①寫出SO2與FeCl3溶液反應的離子方程式____________;
②檢驗有Fe2+生成的方法是____________;
③該小組同學向C試管反應后的溶液中加入硝酸酸化的BaCl2溶液,若出現白色沉淀,即可證明反應生成了SO42 -,該做法不合理,理由是____________。
(4)D裝置中倒置漏斗的作用是____________。
(5)為了驗證SO2具有還原性,實驗中可以代替FeCl3的試劑有____________(填字母)。
a.濃H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應A![]() C由兩步反應A→B→C構成,1molA發生反應的能量曲線如圖所示。下列有關敘述正確的是
C由兩步反應A→B→C構成,1molA發生反應的能量曲線如圖所示。下列有關敘述正確的是
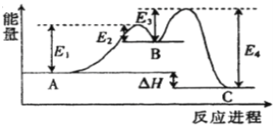
A. A![]() C的正反應為吸熱反應
C的正反應為吸熱反應
B. 加入催化劑會改變A與C的能量差
C. A![]() C正反應的活化能大于其逆反應的活化能
C正反應的活化能大于其逆反應的活化能
D. A![]() C的反應熱△H=E1+E3-E2-E4
C的反應熱△H=E1+E3-E2-E4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近我國成功研制出高效電催化固氮催化劑Mo2N,如圖所示,在0.1mol·L-1鹽酸溶液中,在一定電壓下具有較高的產氨速率和穩定的電流效率。下列判斷錯誤的是
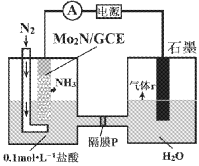
A. 石墨電極為陽極
B. P為陽離子交換膜
C. Mo2N/GCE電極區反應式為N2+6H++6e-=2NH3
D. 為提高溶液的導電性,可在石墨電極區加入適量的鹽酸
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com