
| A. | 2.24L | B. | 4.48L | C. | 6.72L | D. | 7.84 |
分析 反應后的溶液中加入足量氫氧化鈉溶液,金屬元素全部沉淀,得到的沉淀是Cu(OH)2和Mg(OH)2的混合物,質量增加量為沉淀中OH-的質量,計算氫氧根的物質的量,由電荷守恒可知,金屬提供電子等于沉淀中氫氧根的物質的量,采用極值法計算:假設得到的氣體全是NO,假設得到的氣體全是NO2,根據電子轉移守恒計算氣體物質的量,再計算生成氣體體積,混合氣體體積在二者之間.
解答 解:反應后的溶液中加入足量氫氧化鈉溶液,金屬元素全部沉淀,得到的沉淀是Cu(OH)2和Mg(OH)2的混合物,質量增加量為沉淀中OH-的質量,所以m(OH-)=10.7g-5.6g=5.1g,則n(OH-)=$\frac{5.1g}{17g/mol}$=0.3 mol,由電荷守恒可知,金屬提供電子等于沉淀中氫氧根的物質的量,即Cu、Mg共失去0.3 mol電子,
假設得到的氣體全是NO,由電子轉移守恒可知,n(NO)=$\frac{0.3mol}{5-2}$=0.1mol,所以NO體積是:0.1 mol×22.4 L/mol=2.24 L,
假設得到的氣體全是NO2,由電子轉移守恒可知,n(NO2)=$\frac{0.3mol}{5-4}$=0.3mol,所以NO2體積是:0.3 mol×22.4 L/mol=6.72 L,
因為得到是混合氣體,因此體積在二者之間,即2.24<V<6.72,
故選B.
點評 本題考查了混合物計算,難度中等,利用守恒思想計算,避免難以確定Fe反應后的價態,關鍵是確定氫氧根離子所帶電荷等于金屬失去的電子.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 酸性氧化物:CO2、SO2、SiO2、Cl2O7 | |
| B. | 混合物:鋁熱劑、純凈礦泉水、水玻璃、焦爐氣 | |
| C. | 同素異形體:石墨與金剛石、氧氣與臭氧 | |
| D. | 非電解質:蔗糖、四氯化碳、氨氣、氯氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 0.1 mol•L-1氯化銨溶液中:c(H+)>c(OH-)>c(Cl-)>c(NH4+) | |
| B. | pH=2的醋酸中:c(H+)=0.02mol•L-1 | |
| C. | 飽和碳酸鈉溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | pH=12的NaOH溶液與pH=2 CH3COOH混合后所得溶液中:c(H+)<c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 四種溶液的pH的大小順序:①>④>③>② | |
| B. | 將溶液①、②等體積混合所得堿性溶液中:c(NH4+)<c(NH3•H2O) | |
| C. | 向溶液①、②中分別滴加25mL 0.1mol•L-1鹽酸后,溶液中c(NH4+):①>② | |
| D. | 將溶液③、④等體積混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將水加熱到100℃,pH=6:c(H+)>c(OH-) | |
| B. | 0.1mol•L-1 的硫酸銨溶液中:c(NH4+)>c(SO42-)>c(H+) | |
| C. | 室溫下,pH=7的醋酸和醋酸鈉的混合溶液中:c(CH3COO-)>c(Na+) | |
| D. | 同濃度的三種溶液:①CH3COONH4②NH4Cl③NH3•H2O中,c(NH4+)由大到小的順序是②③① |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O與Na2O2顏色相同 | B. | 均可與CO2、H2O反應產生氧氣 | ||
| C. | 所含氧元素的化合價均為-2 | D. | 陰陽離子的個數比均為1:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 試管里的油污先用熱的純堿溶液洗,再用清水沖洗 | |
| B. | 先把試管里的廢液倒入下水道中,再用清水沖洗 | |
| C. | 附有氫氧化鐵沉淀的試管,先用燒堿溶解,再用清水沖洗 | |
| D. | 盛放石灰水后殘留下固體物質的燒杯,先用肥皂水洗,再用清水沖洗 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
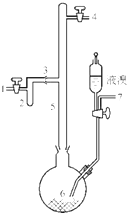 利用廢鋁箔(主要成分為Al、少量的Fe、Si等)既可制取有機合成催化劑AlBr3又可制取凈水劑硫酸鋁晶體[A12(SO4)3•18H2O].
利用廢鋁箔(主要成分為Al、少量的Fe、Si等)既可制取有機合成催化劑AlBr3又可制取凈水劑硫酸鋁晶體[A12(SO4)3•18H2O].查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com