
下列指定反應的離子方程式正確的是
A.BaSO3與稀HNO3反應:BaSO3+2H+=Ba2++SO2↑+H2O
B.Ca(OH)2溶液與過量NaHCO3溶液反應:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.酸性溶液中KIO3與KI反應生成I2:IO 3-+I-+6H+=I2+3H2O
3-+I-+6H+=I2+3H2O
D.向CuSO4 溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4
溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4 Na++2Cu(OH)2↓+O2↑
Na++2Cu(OH)2↓+O2↑
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2016-2017學年天津市寶坻區高二11月聯考化學試卷(解析版) 題型:填空題
已知可逆反應2NO(g) N2(g)+O2(g)。若在某溫度下達到平衡時C(N2)=0.05mol·L-1,C(O2)=0.05mol·L-1,c(NO)=0.1mol·L-1 該反應的平衡常數為_____________。保持溫度不變,將容器體積縮小一半,則平衡常數_________(填增大、減小或不變);
N2(g)+O2(g)。若在某溫度下達到平衡時C(N2)=0.05mol·L-1,C(O2)=0.05mol·L-1,c(NO)=0.1mol·L-1 該反應的平衡常數為_____________。保持溫度不變,將容器體積縮小一半,則平衡常數_________(填增大、減小或不變);
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省高三新考試大綱適應性考試化學卷(解析版) 題型:實驗題
[化學—選修5:有機化學基礎]A的產量可以用來衡量—個國家的石油化工發展水平。用A為原料可以合成一種醚類香料和一種縮醛類香料。具體合成路線如下圖所示(部分反應條件略去):
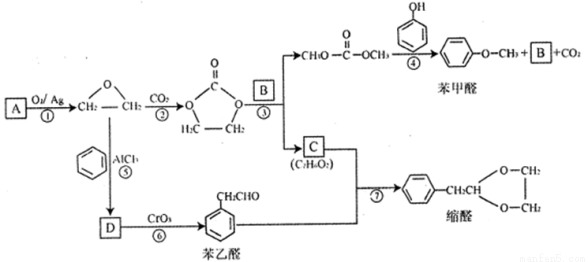
回答下列問題:
(1)A的名稱是_______,圖中縮醛的分子式是_______________。
(2)B的結構簡式為__________,C中含有的官能團名稱是________________。
(3)D為單取代芳香族化合物且能與金屬鈉反應。反應⑤的化學方程式為_______________。
(4)反應⑥的反應類型是__________________。
(5)寫出滿足下列條件的苯乙醛的所有同分異構體的結構簡式:______________。
A.含有苯環和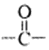 結構;B.核磁共振氫譜有4組峰,且峰面積之比為3:2:2:1
結構;B.核磁共振氫譜有4組峰,且峰面積之比為3:2:2:1
(6)參照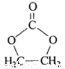 的合成路線,設計一條由2-氯丙烷制備
的合成路線,設計一條由2-氯丙烷制備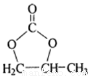 的合成路線(注明必要的反應條件)________________。
的合成路線(注明必要的反應條件)________________。
查看答案和解析>>
科目:高中化學 來源:2017屆河北省高三上第三次階段測化學試卷(解析版) 題型:選擇題
向 BaCl2 溶液中依次通入氣體 X 和 Y,下列各組不會出現沉淀的是
選項 | X | Y |
A | NH3 | CO2 |
B | Cl2 | CO2 |
C | SO2 | NO2 |
D | Cl2 | SO2 |
查看答案和解析>>
科目:高中化學 來源:2017屆廣西省欽州市欽州港區高三12月月考化學試卷(解析版) 題型:填空題
目前工業合成氨的原理是:N2(g)+3H2(g)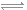 2NH3(g) △H=-93.0kJ/mol
2NH3(g) △H=-93.0kJ/mol
(1)己知一定條件下:2N2(g)+6H2O(l)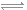 4NH3(g)+3O2(g) △H=+1530.0kJ/mol。則表示氫氣燃燒熱的熱化學方程式為____________________。
4NH3(g)+3O2(g) △H=+1530.0kJ/mol。則表示氫氣燃燒熱的熱化學方程式為____________________。
(2)在恒溫恒容裝置中進行合成氨反應,各組分濃度-時間圖像如下。
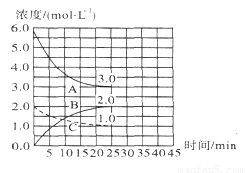
① 表示N2濃度變化的曲線是 (填序號)。
② 前25min 內,用H2濃度變化表示的化學 反應速率是 。
反應速率是 。
③ 在25min時,采取下列措施,能使N2的轉化率提高的是__________(填序號)。
a. 通入1molN2
b. 通入1molH2
c. 通入1molHe氣
d. 通入1molHCl
e. 通入1molN2和3molH2
(3)在恒溫恒壓裝置中進行工業合成氨反應,下列說法錯誤的是__________(填序號)。
a.氣體體積不再變化,則已平衡
b.氣體密度不再變化,則已平衡
c.平衡后,壓縮容器,會生成更多NH3
d.平衡后,往裝置中通入一定量Ar,平衡不移動
(4)電廠煙氣脫氮:主反應為:①4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0
5N2(g)+6H2O(g) △H<0
副反應為:②2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0
5N2O(g)+3H2O(g) △H>0
平衡混合氣中N2與N2O含 量與溫度的關系如圖所示。
量與溫度的關系如圖所示。

請回答:在400~600K時,隨溫度的升高,平衡混合氣中N2含量_____________(填“升高”、“降低”或“不變”),導致這種規律的原因是_______________________。
查看答案和解析>>
科目:高中化學 來源:2017屆廣西省欽州市高新區高三12月月考化學試卷(解析版) 題型:填空題
I.氮及其化合物在工農業生產、生活中有著重要應用,減少氮的氧化物在大氣中的排放是環境保護的重要內容之一。
(1)已知:2NO(g) = N2(g)+O2(g) △H=﹣180.5kJ•mol-¹
C(s)+O2(g)=CO2(g) △H=﹣393.5 kJ•mol -¹
-¹
2C(s)+O 2(g)=2CO(g) △H=﹣221kJ•mol-¹
若某反應的平衡常數表達式為: ,請寫出此反應的熱化學方程式 。
,請寫出此反應的熱化學方程式 。
(2)N2O5在一定條件下可發生分【解析】
2N2O5(g)=4NO2(g)+O2(g)。某溫度下測得恒容密閉容 器中N2O5濃度隨時間的變化如下表:
器中N2O5濃度隨時間的變化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①2.00min~5.00 min內,NO2的平均反應速率為 ;已知氣體的物質的量與體系壓強成正比,若反應開始時體系壓強為P0,第4.00 min時體系壓強為P1,則P1∶ P0= ;
P0= ;
②一定溫度下,在恒容密閉容器中充入一定量N2O5進行該反應,能判斷反應已達到化學平衡狀態的是 。
a.容器中壓強不再變化 b.NO2和O2的體積比保持不變
c.2υ正(NO2)=υ逆(N2O5) d.氣體的密度保持不變
II.雙氧水是一種重要的綠色試劑,工業上可采取電解較稀濃度的硫酸來制取雙氧水(H2O2只為還原產物),其電解的化學方程式為:3H2O+3O2  O3+3H2O2。則陽極的電極反應式為 ,陰極的電極反應式為 。
O3+3H2O2。則陽極的電極反應式為 ,陰極的電極反應式為 。
查看答案和解析>>
科目:高中化學 來源:2017屆廣西省欽州市高新區高三12月月考化學試卷(解析版) 題型:選擇題
分子式為C8H16O2的酯A,能在酸性條件下水解生成B和C,且B在一定條件下能氧化成D。D與C互為同分異構體。則有機物A可能的結構有
A.4種 B.3種 C.2種 D.1種
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省高二上月考五化學卷(解析版) 題型:選擇題
.在鐵和氧化鐵混合物15 g中,加入稀硫酸150 mL,能放出H2 1.68 L(標準狀況)。同時鐵和氧化鐵均無剩余,向反應后的溶液中滴入KSCN溶液,未見顏色變化。為了中和過量的H2SO4,且使Fe2+完全轉化成Fe(OH)2,共消耗3 mol ·L-1的NaOH溶液200 mL,則原硫酸的物質的量濃度是
·L-1的NaOH溶液200 mL,則原硫酸的物質的量濃度是
A.1.5 mol·L-1 B.2 mol·L-1 C.2.5 mol·L-1 D.3 mol·L-1
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北省高二12月月考化學卷(解析版) 題型:選擇題
用電動公交車初 步替代燃油公交車是天津市節能減排、控制霧霾的重要舉措之一。Li-Al/FeS電池是一種正在開發的車載電池,該電池中正極的電極反應式為:2Li++FeS+2e-=Li2S+Fe,有關該電池的下列說法中,正確的是
步替代燃油公交車是天津市節能減排、控制霧霾的重要舉措之一。Li-Al/FeS電池是一種正在開發的車載電池,該電池中正極的電極反應式為:2Li++FeS+2e-=Li2S+Fe,有關該電池的下列說法中,正確的是
A.電池反應的化學方程式為:2Li+FeS=Li2S+Fe
B.負極的電極反應式為:Al-3e-=Al3+
C.Li—Al在電池中作為負極材料,該材料中Li的化合價是+1
D.電池充電時,陰極反應為:Li2S+Fe-2e-=2Li++FeS
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com