
【題目】重金屬元素鉻的毒性較大,含鉻廢水需經處理達標后才能排放。
Ⅰ.某工業廢水中主要含有Cr3+,同時還含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性較強。為回收利用,通常采用如下流程處理:
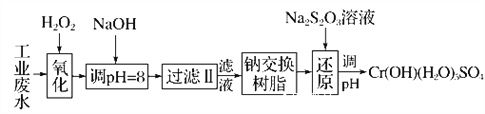
注:常溫下,部分陽離子以氫氧化物形式完全沉淀時所需的pH,如下表:
氫氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
(1)氧化過程中可代替H2O2加入的試劑是________(填字母,下同)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液調整溶液pH=8時,除去的離子是________;
已知鈉離子交換樹脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交換除去的雜質離子是____________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)還原過程在酸性條件下進行,每消耗0.8 mol Cr2O![]() 轉移4.8 mol e-,該反應離子方程式為________________________________________________________________________。
轉移4.8 mol e-,該反應離子方程式為________________________________________________________________________。
Ⅱ.酸性條件下,六價鉻主要以Cr2O![]() 形式存在,工業上常用電解法處理含Cr2O
形式存在,工業上常用電解法處理含Cr2O![]() 的廢水,該法用Fe作電極電解含Cr2O
的廢水,該法用Fe作電極電解含Cr2O![]() 的酸性廢水,隨著電解進行,在陰極附近溶液pH升高,產生Cr(OH)3溶液。
的酸性廢水,隨著電解進行,在陰極附近溶液pH升高,產生Cr(OH)3溶液。
(1)電解時能否用Cu電極來代替Fe電極?________(填“能”或“不能”),理由是_____________。
(2)常溫下,Cr(OH)3的溶度積Ksp=1×10-20,假設溶液的c(Cr3+)=0.01mol/L,當pH應為______時開始生成沉淀。
【答案】 A AB CD 3S2O![]() +4Cr2O
+4Cr2O![]() +26H+===6SO
+26H+===6SO![]() +8Cr3++13H2O 不能 因陽極產生的Cu2+不能使Cr2O
+8Cr3++13H2O 不能 因陽極產生的Cu2+不能使Cr2O![]() 還原到低價態 8
還原到低價態 8
【解析】I.某工業廢水中主要含有Cr3+,同時還含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加雙氧水把亞鐵離子氧化為鐵離子,同時Cr3+被氧化為Cr2O72-,加氫氧化鈉調節pH=8,則Fe3+、Al3+轉化為氫氧化鐵和氫氧化鋁沉淀,過濾,濾液中主要含有Cr2O72-、Ca2+和Mg2+等,通過鈉離子交換樹脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-還原為Cr3+,再調節pH得到Cr(OH)(H2O)5SO4,
(1)加氧化劑主要目的是把亞鐵離子氧化為鐵離子,同時不能引入新的雜質,所以可以用Na2O2代替H2O2,故答案為:A;
(2)根據表中數據可知,pH=8時,Fe3+、Al3+轉化為氫氧化鐵和氫氧化鋁沉淀,則Fe3+、Al3+被除去;通過鈉離子交換樹脂,除去Ca2+和Mg2+;故答案為:AB;CD;
(3)每消耗0.8molCr2O72-轉移4.8mole,則1molCr2O72-轉移6mol電子,所以生成Cr3+,S2O32-被氧化為SO42-,則反應的離子方程式為:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;故答案為:3S2O32-+4Cr2O72-+26H+===6SO42-+8Cr3++13H2O
II.(1)若用Cu電極來代替Fe電極,在陽極上銅失去電子得到的陽離子是銅離子,該離子不具有還原性,不能和重鉻酸根之間發生反應,故答案為:不能;因陽極產生的Cu2+不能使Cr2O72-還原到低價態;
(2)由Cr(OH)3的溶度積Ksp=1×10-20可得Ksp=c(Cr3+)×c3(OH)=0.01×c3(OH)=1×10-20,c(OH)=1×10-6,所以c(H+)=1×10-8,pH=8,故答案為:8


科目:高中化學 來源: 題型:
【題目】烴A是一種重要的化工原料,已知A在標準狀況下的密度為1.25g·L-1,D是塑料的主要成分,據此回答下列有關問題:

(1)A的結構簡式為__________。
(2)反應⑤的反應類型為__________。
(3)反應⑥的方程式為__________。
(4)下列說法不正確的是__________。
A.通過石蠟油的裂化可以得到多種A的同系物,如丙烯
B.反應⑨的條件是氯氣、光照
C.反應⑦的反應類型為消去反應
D.反應④為加聚反應,得到的產物可使酸性高錳酸鉀溶液褪色
E.得到C有多種途徑,通過途徑⑧⑨得到C,產率較低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組欲測定室溫下(25 ℃、101 kPa)的氣體摩爾體積,請回答以下問題。
該小組設計的簡易實驗裝置如圖所示:
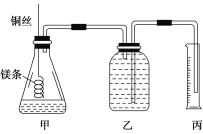
該實驗的主要操作步驟如下:
①配制100 mL 1.0 mol/L的鹽酸溶液;
②用________(填儀器名稱并注明規格)量取10.0 mL 1.0 mol/L的鹽酸溶液加入錐形瓶中;
③稱取a g已除去表面氧化膜的鎂條,并系于銅絲末端,為使HCl全部參加反應,a的數值至少為________;
④往廣口瓶中裝入足量水,按上圖連接好裝置,檢查裝置的氣密性;
⑤反應結束后待體系溫度恢復到室溫,讀出量筒中水的體積為V mL。
請將上述步驟補充完整并回答下列問題。
(1)用文字表述實驗步驟④中檢查裝置氣密性的方法:
___________________________________________________
(2)實驗步驟⑤中應選用________(填序號)的量筒。
A.100 mol B.200 mL C.500 mL
讀數時除恢復到室溫外,還要注意_________________________________________。
(3)若忽略水蒸氣的影響,在實驗條件下測得氣體摩爾體積的計算式為Vm=________,若未除去鎂條表面的氧化膜,則測量結果________(填“偏大”、“偏小”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通過以下反應均可獲取CO。下列有關說法正確的是
①木炭不完全燃燒制CO:2C(s)+O2(g)=2CO(g) ΔH1=-221kJ·mol-1
②木炭還原CO2制CO:C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
③焦炭還原Fe2O3制CO:Fe2O3(s) + 3C(s) ![]() 2Fe(s) + 3CO(g) ΔH 3=+489.0kJ·mol-1
2Fe(s) + 3CO(g) ΔH 3=+489.0kJ·mol-1
A. 反應①中化學能全部轉化為熱能
B. 反應②為吸熱反應,在任何情況下都不能自發進行
C. 反應③中使用催化劑或移走部分CO,均可提高Fe2O3的轉化率
D. 反應Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) ΔH =-28.5 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關能量的說法不正確的是( )
A.化石能源物質內部貯存著大量的能量
B.植物的光合作用使太陽能轉化為化學能
C.燃料燃燒時只能將化學能轉化為熱能
D.電能是常用的二次能源
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知有下列反應:
①2H2O+Cl2+SO2===H2SO4+2HCl
②2KMnO4+16HCl(濃) ===2KCl+2MnCl2+5Cl2↑+8H2O
根據上述兩個反應回答:
(1)Cl2、KMnO4、H2SO4三者氧化性強弱順序為______________,Cl-、SO2、Mn2+三者還原性強弱順序為___________。
(2)反應①中氧化產物和還原產物的質量之比為________。
(3)反應②中濃鹽酸表現出的性質是________。
A.還原性 B.酸性 C.氧化性
(4)用雙線橋法標出反應②電子轉移的方向和數目_________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關電池的說法不正確的是( )
A.手機上用的鋰離子電池屬于二次電池
B.鋅錳干電池中,鋅電極是負極
C.氫氧燃料電池可把化學能轉化為電能
D.南孚電池到達壽命無法使用時可隨意丟棄
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下廣告語或說法中,符合科學道理的是()
A. “超純凈水”絕對衛生,對人有益
B. 加鐵強化醬油可預防缺鐵性貧血
C. 無糖餅干中不含糖類物質
D. 本飲料純天然,絕對不含化學物質,對人無害
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com