
【題目】NA為阿伏加德羅常數,下列說法正確的是
A. 28g乙烯所含共用電子對數目為2NA
B. 14g乙烯、丙烯、丁烯的混合氣體中,所含原子數為3NA
C. 標準狀況下,11.2L氟化氫所含分子數為0.5NA
D. 1.5g甲基所含電子數為NA
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】(1)同溫同壓下,同體積的甲烷(CH4)和二氧化碳物質的量之比為__________,原子總數之比為__________,密度之比為__________。
(2)在標準狀況下,4 g H2、11.2 L O2、1 mol H2O中,所含分子數最多的是__________,質量最大的是__________,體積最小的是__________。
(3)標況下,1.92 g 某氣體的體積為 672 mL,則此氣體的相對分子質量為_____。
(4)已知某硫酸溶液的密度為 1.84 g/cm3,質量分數為 98%,則該硫酸的物質的量濃度為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組研究了銅片與![]() 反應的速率,實現現象記錄如下表。
反應的速率,實現現象記錄如下表。
實驗 | 時間段 | 現象 |
|
| 銅片表面出現極少氣泡 |
| 銅片表面產生較多氣泡,溶液呈很淺的藍色 | |
| 銅片表面均勻冒出大量氣泡 | |
| 銅片表面產生較少氣泡,溶液藍色明顯變深,液面上方呈淺棕色 |
為探究影響該反應速率的主要因素,小組進行如下實驗。
實驗I:監測上述反應過程中溶液溫度的變化,所得曲線如下圖。
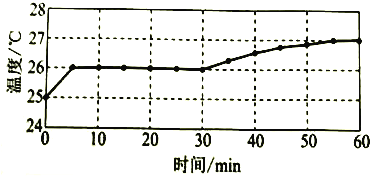
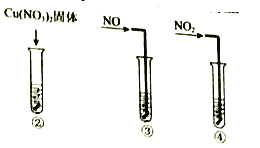
實驗II:②-④試管中加入大小、形狀相同的銅片和相同體積、 ![]() 。結果顯示:
。結果顯示:![]() 對
對![]() 和
和![]() 反應速率的影響均不明顯,
反應速率的影響均不明顯,![]() 能明顯加快該反應的速率。
能明顯加快該反應的速率。
實驗III:在試管中加入銅片和![]() ,當產生氣泡較快時,取少量反應液于試管中,檢驗后發現其中含有
,當產生氣泡較快時,取少量反應液于試管中,檢驗后發現其中含有![]() 。
。
(1)根據表格中的現象,描述該反應的速率隨時間的變化情況:____________。
(2)實驗![]() 的結論:溫度升高___________(填“是”或“不是”)反應速率加快的主要原因。
的結論:溫度升高___________(填“是”或“不是”)反應速率加快的主要原因。
(3)實驗II的目的是:__________
(4)小組同學查閱資料后推測:該反應由于生成某中間產物而加快了反應速率。請結合實驗II、III,在下圖方框內填入相應的微粒符號①____②_____,以補全催化機理。
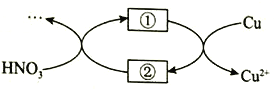
(5)為驗證(4)中猜想,還需補充一個實驗:__________(請寫出操作和現象)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】類比法是常見的研究物質性質的方法之一,可用來預測很多物質的性質,但類比是相對的,必須遵循客觀實際,下列說法中正確的是( )
A. ![]() 通入
通入![]() 溶液中沒有現象,
溶液中沒有現象,![]() 通入
通入![]() 溶液中也無明顯現象
溶液中也無明顯現象
B. ![]() 與
與![]() 會因為水解相互促進而完全反應生成
會因為水解相互促進而完全反應生成![]() 和
和![]() ,
,![]() 與
與![]() 也可以水解相互促進至完全反應生成
也可以水解相互促進至完全反應生成![]() 和
和![]()
C. 偏鋁酸是一元酸,因此,![]() 也是一元酸
也是一元酸
D. ![]() 在標準狀況下為氣體,所以
在標準狀況下為氣體,所以![]() 在標準狀況下同樣為氣體
在標準狀況下同樣為氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是化工合成中最重要的鎳源,在實驗室中模擬工業上利用金屬鎳廢料(含鎳、鐵、鋁)生產氯化鎳晶體
是化工合成中最重要的鎳源,在實驗室中模擬工業上利用金屬鎳廢料(含鎳、鐵、鋁)生產氯化鎳晶體![]() 流程如下:
流程如下:

下表列出了相關金屬離子生產氫氧化物沉淀的pH:
氫氧化物 |
|
|
|
|
開始沉淀的pH | 7.6 | 2.7 | 7.1 | 3.7 |
沉淀完全的pH | 9.6 | 3.7 | 9.2 | 4.7 |
回答下列問題:
(1)加入![]() 氧化時發生反應的離子方程式為________________________,調pH的范圍為____________,若調
氧化時發生反應的離子方程式為________________________,調pH的范圍為____________,若調![]() ,則溶液中
,則溶液中![]() _______________。(已知
_______________。(已知![]() ,
,![]() )
)
(2)濾液A的溶質主要是______________________。
(3)操作①的實驗方法依次是_____________、_____________、過濾、洗滌、干燥,操作②的實驗方法是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中水只作還原劑的是
A.2H2O+2Na=2NaOH+H2↑
B.H2O + 3NO2 = 2HNO3 + NO
C.2H2O + 2F2 = O2 + 4HF
D.3H2O (沸水) + FeCl3![]() Fe (OH)3(膠體) + 3HCl
Fe (OH)3(膠體) + 3HCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通常情況下,pH<7 的溶液顯酸性,pH=7 的溶液顯中性,pH>7 的溶液顯堿性。以 FeCl3 溶液為實驗對象,探究其與堿性物質之間反應的復雜多樣性。實驗如下:
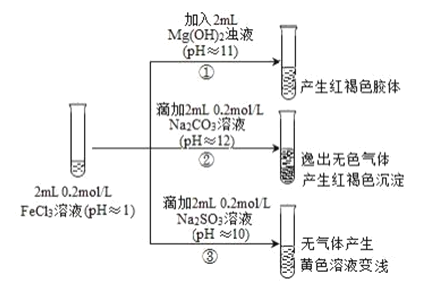
已知:含 Fe2+的溶液中加入 K3Fe(CN)6 溶液生成藍色沉淀。K3Fe(CN)6 = 3K++Fe(CN)6 3-
(1)①中反應的離子方程式是______。
(2)寫出②中發生反應的化學方程式______。
(3)對于③中的實驗現象,同學們有諸多猜測,繼續進行實驗:
甲組:取③中反應后溶液少許,滴入稀鹽酸酸化,再滴加 BaCl2 溶液,產生白色沉淀。得出結論:FeCl3 與 Na2SO3 發生了氧化還原反應,其中SO32-被氧化生成了______(填離子的化學式)。
乙組:認為甲組的實驗不嚴謹,重新設計并進行實驗,證實了甲組的結論是正確的。其實驗方案是取③中反應后的溶液,加入 K3Fe(CN)6 溶液,生成______(填藍色沉淀的化學式,沉淀中不含鉀元素),說明生成了 Fe2+。請寫出 FeCl3 與 Na2SO3 溶液反應的離子方程式:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電浮選凝聚法是工業上采用的一種污水處理方法:保持污水的pH在5.0~6.0之間,通過電解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉積下來,具有凈化水的作用。陰極產生的氣泡把污水中懸浮物帶到水面形成浮渣層,刮去(或撇掉)浮渣層,即起到了浮選凈化的作用。某科研小組用電浮選凝聚法處理污水,設計裝置示意圖,如圖所示。
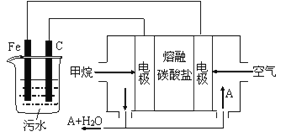
(1)實驗時若污水中離子濃度較小,導電能力較差,產生氣泡速率緩慢,無法使懸浮物形成浮渣。此時,應向污水中加入適量的__________。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH
(2)電解池陽極發生了兩個電極反應,電極反應式分別是
Ⅰ.___________________; Ⅱ._________________;
(3)電極反應Ⅰ和Ⅱ的生成物反應得到Fe(OH)3沉淀的離子方程式是__________________;
(4)該燃料電池是以熔融碳酸鹽為電解質,CH4為燃料,空氣為氧化劑,稀土金屬材料做電極。
①負極的電極反應是____________________;
②為了使該燃料電池長時間穩定運行,電池的電解質組成應保持穩定,電池工作時必須有部分A物質參加循環(見上圖)。A物質的化學式是_________________;
(5)實驗過程中,若在陰極產生了44.8 L(標準狀況)氣體,則熔融鹽燃料電池消耗CH4(標準狀況)____L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com