
【題目】日用牙膏的主要成分有:活性物質、摩擦劑、甘油等。假設牙膏中摩擦劑成分為CaCO3、Al(OH)3,且牙膏中其它成分不與酸、堿反應。某校化學興趣小組利用下圖所示裝置(圖中夾持儀器略去)進行實驗,充分反應后,通過測定C中生成的BaCO3沉淀質量,以確定該牙膏中碳酸鈣的質量分數。

依據實驗過程回答下列問題:
(1)儀器組裝完成后,密封裝置A的進氣口和裝置D的出氣口,分液漏斗中裝水,打開分液漏斗的兩個活塞,若_________ ,則整套裝置不漏氣。
(2)裝置A中盛放的試劑是______,其作用是________。
(3)儀器C中選擇Ba(OH)2而不選擇Ca(OH)2溶液原因:__________、_________。
(4)下列各項措施中,能提高測定準確精度的是______________。(填標號)
a.在加入鹽酸之前,應排凈裝置內的CO2氣體
b.在A~B之間增添盛有濃硫酸的洗氣裝置
c.在B~C之間增添盛有飽和碳酸氫鈉溶液的洗氣裝置
d.緩慢滴加稀鹽酸
(5)如果沒有裝置D,則所測CaCO3的質量分數將_______。(選填“偏高”、“不變”或“偏低”)
(6)反應中鹽酸必須過量,稱量結束后,判斷稀鹽酸已過量的實驗操作是___________ 。(寫出實驗步驟和現象)
(7)實驗中準確稱取16.00 g樣品三份,進行三次測定,測得BaCO3平均質量為7.88 g,樣品中碳酸鈣的質量分數為 。
【答案】
(1)一定時間后即滴不進去且分液漏斗中液面保持不變(2分)
(2)氫氧化鈉溶液(1分) 吸收空氣中的二氧化碳(1分)
(3)氫氧化鋇的溶解度大,可以配制較高的濃度溶液(1分)
產物碳酸鋇的相對分子量大,可以減小實驗誤差(1分)
(4)ad(2分)
(5)偏高(2分)
(6)取反應后錐形瓶中的少量溶液于試管中,滴加紫色石蕊試液,溶液變紅色(2分)
(7)25.0%(2分)
【解析】
試題分析:
(1)儀器組裝完成后,密封裝置A的進氣口和裝置D的出氣口,分液漏斗中裝水,打開分液漏斗的兩個活塞,若一定時間后即滴不進去且分液漏斗中液面保持不變,則整套裝置不漏氣,整套裝置氣密性良好。
(2)由于空氣中也含有二氧化碳,所以裝置A中盛放的試劑是氫氧化鈉溶液,其作用是吸收空氣中的二氧化碳;
(3)氫氧化鋇的溶解度比氫氧化鈣的溶解度大得多,單位體積內氫氧化鋇溶解的量多,吸收效果好,另碳酸鋇的相對分子量比碳酸鈣的相對分子量大得多,稱量讀數時誤差小;
(4)a.在加入鹽酸之前,應排凈裝置內的CO2氣體,防止影響碳酸鋇質量,提高測定準確度,a正確;b.在A~B之間增添盛有濃硫酸的洗氣裝置,吸收水,對碳酸鋇的質量無影響,b錯誤;c.在B~C之間增添盛有飽和碳酸氫鈉溶液的洗氣裝置,吸收氯化氫的同時生成二氧化碳,影響測定的準確度,c錯誤;d.緩慢滴加稀鹽酸,防止滴加過快二氧化碳不能完全被吸收,排出C裝置,提高測定準確度,d正確;
(5)如果沒有裝置D,則空氣中的二氧化碳也能與氫氧化鋇反應,所以所測CaCO3的質量分數將偏高;
(6)稱量結束后,判斷稀鹽酸已過量的方法為:取反應后錐形瓶中的少量溶液于試管中,滴加紫色石蕊試液,溶液變紅色;
(7)根據碳元素守恒可知關系式:CaCO3~BaCO3,BaCO3平均質量為7.88g,所以碳酸鈣的質量為![]() ×100=4.00g,因此樣品中碳酸鈣的質量分數為
×100=4.00g,因此樣品中碳酸鈣的質量分數為![]() ×100%=25.0%。
×100%=25.0%。


 活力試卷系列答案
活力試卷系列答案 課課優能力培優100分系列答案
課課優能力培優100分系列答案科目:高中化學 來源: 題型:
【題目】H為芳香酯,其合成路線如下圖,A ~ G 均為芳香族化合物,B能發生銀鏡反應,D的相對分子質量比C大4,E的核磁共振氫譜有3組峰

①2RCH2CHO![]() R-
R-![]()
②![]()
![]()
![]()
請回答下列問題:
(1)A的名稱是________,B含有的官能團的名稱是________;
(2)A→B的反應類型為________,C→D的反應類型是________;
(3)B、E的結構簡式分別為___________、___________;
(4)E→F與F→G的順序能否顛倒_____(填“能”或“否”),理由_______;
(5)符合下列要求的A的同分異構體有多種,其中核磁共振氫譜為4組峰,且面積比為6:2:1:1_________;(寫出其中一種的結構簡式)。
①與Na反應并產生H2 ②芳香族化合物
(6)根據已有知識,結合相關信息,寫出CH3CH2OH為原料制備CH3CH2CH2CH2OH的合成流程圖(無機試劑任選),合成流程示意圖如下:
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】著名丹麥物理學家尼·玻爾(N·Bohr)將他鐘愛的金制諾貝爾獎章用王水溶解成“金溶液”,化學方程式可簡單表示為:Au+HNO3+3HCl===AuCl3+NO↑+2H2O,AuCl3+HCl===HAuCl4(四氯合金酸)。納粹分子對這種溶液“愚笨”得視而不見、毫無所知。戰爭結束后,物理學家又根據以下反應,煉出黃金并鑄出更加燦爛奪目的獎章:2HAuCl4![]() 2HCl↑+3Cl2↑+2Au。表現出偉大科學家對祖國的無比熱愛和非凡智慧。下列敘述中正確的是( )
2HCl↑+3Cl2↑+2Au。表現出偉大科學家對祖國的無比熱愛和非凡智慧。下列敘述中正確的是( )
A.王水能溶解黃金,但不能溶解白金
B.HAuCl4具有很強的氧化性
C.鹽酸有很強的還原性
D.濃鹽酸和濃硝酸按照體積比1:3能配成王水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】己二酸 是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如下:
是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如下:
![]()

可能用到的有關數據如下:
物質 | 密度(20℃) | 熔點 | 沸點 | 溶解性 | 相對分子質量 |
環己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃時水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃時,1.44g,25℃時2.3g,易溶于乙醇,不溶于苯 | 146 |
實驗步驟如下:
I、在三口燒瓶中加入16mL50%的硝酸(密度為1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL環己醇。
Ⅱ、水浴加熱三口燒瓶至50℃左右,移去水浴,緩慢滴加5~6滴環己醇,搖動三口燒瓶,觀察到有紅棕色氣體放出時再慢慢滴加剩下的環己醇,維持反應溫度在60℃~65℃之間。
Ⅲ、當環己醇全部加入后,將混合物用80℃~90℃水浴加熱約10min(注意控制溫度),直至無紅棕色氣體生成為止。
IV、趁熱將反應液倒入燒杯中,放入冰水浴中冷卻,析出晶體后過濾、洗滌得粗產品。
V、粗產品經提純后稱重為5.7g。
請回答下列問題:
(1)滴液漏斗的細支管a的作用是_____________,儀器b的名稱為_____________。
(2)已知用NaOH溶液吸收尾氣時發生的相關反應方程式為:
2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O;如果改用純堿溶液吸收尾氣時也能發生類似反應,則相關反應方程式為:_____________、_____________。
(3)向三口燒瓶中滴加環己醇時,要控制好環己醇的滴入速率,防止反應過于劇烈導致溫度迅速上升,否則。可能造成較嚴重的后果,試列舉一條可能產生的后果:_____________。
(4)為了除去可能的雜質和減少產品損失,可分別用冰水和_____________洗滌晶體。
(5)粗產品可用_____________法提純(填實驗操作名稱).本實驗所得到的己二酸產率為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學—選修3物質結構與性質】已知A、B、C、D、E都是周期表中前四周期的元素,它們的原子序數依次增大。其中A元素原子的核外p電子數比s電子數少1。C是電負性最大的元素。D原子次外層電子數是最外層電子數2倍,E是第Ⅷ族中原子序數最小的元素。
(1)寫出基態C原子的電子排布式 。
(2)A、B兩種元素的第一電離能由大到小的順序為____ (用元素符號表示),原因是 。
(3)已知DC4常溫下為氣體,則該物質的晶體類型是 ,組成微粒的中心原子的軌道雜化類型為 ,空間構型是 。
(4)Cu2+容易與AH3形成配離子[Cu(AH3)4]2+,但AC3不易與Cu2+形成配離子,其原因是 。
(5)A、B兩元素分別與D形成的共價鍵中,極性較強的是 。A、B兩元素間能形成多種二元化合物,其中與A3—互為等電子體的物質的化學式為 。
(6)已知E單質的晶胞如圖所示,則晶體中E原子的配位數為 ,一個E的晶胞質量為 。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學—選修5有機化學基礎】有機物H是一種具有很強的親水性高分子化合物。其合成路線如下:
![]()

已知:
①R—CHO+![]()
![]()

![]()
![]() ;
;
②![]()
![]()
![]() ;
;
③B的核磁共振氫譜有兩個峰,且峰面積之比為1∶2。
請回答下列問題:
(1)A的名稱是____________;B的官能團名稱是______________________;
D的結構簡式是____________________。
(2)反應⑤的反應類型是__________。
(3)反應④的化學方程式為______________________________。
(4)C的同分異構體中含有![]() 的有_________種。其中能與NaHCO3反應產生氣體的同分異構體的結構簡式是_________________________________。
的有_________種。其中能與NaHCO3反應產生氣體的同分異構體的結構簡式是_________________________________。
(5)根據已有知識并結合相關信息,仿上述流程,有機物以結構簡式來表示,寫出以甲苯和乙醛為原料制備肉桂醛( )的合成路線流程圖(無機試劑任用):
)的合成路線流程圖(無機試劑任用):
______________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應中的物質變化、能量變化、速率變化及反應的限度均是化學工作者研究的內容。
(1)對于基元反應(即反應物一步轉化為生成物的反應)mA+nB![]() pC+qQ來說,其反應速率v=k正cm(A)cn(B)(可逆反應也存在類似的表達式),k為只與溫度有關的速率常數;對于非基元反應(即不是一步完成的反應),則速率公式中的m、n就不一定均等于A、B的化學計量數,若某一物質對反應速率無影響,則其不會出現在上述公式中。
pC+qQ來說,其反應速率v=k正cm(A)cn(B)(可逆反應也存在類似的表達式),k為只與溫度有關的速率常數;對于非基元反應(即不是一步完成的反應),則速率公式中的m、n就不一定均等于A、B的化學計量數,若某一物質對反應速率無影響,則其不會出現在上述公式中。
某科研小組測量反應“H2O2+2I+2H+![]() I2+H2O”的部分實驗數據如下表所示
I2+H2O”的部分實驗數據如下表所示
c(H2O2)/(mol·L1) | c(I)/(mol·L1) | c(H+)/(mol·L1) | I2的生成速率(mol·L1·s1) |
0.010 | 0.010 | 0.010 | 1.75 |
0.030 | 0.010 | 0.10 | 5.25 |
0.030 | 0.020 | 0.10 | 1.05 |
0.030 | 0.020 | 0.20 | 1.05 |
該反應的反應速率與濃度關系表達式為_________________,速率常數k=____________,該反應_______(填“是”或“不是”)基元反應。
(2)氮的氧化物是造成大氣污染的主要成分之一,有多種方法消除氮氧化物的污染。下列 反應是消除污染的方法之一。
反應Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH =746 kJ·mol1
N2(g)+2CO2(g) ΔH =746 kJ·mol1
反應Ⅱ:CO(g)+NO2(g)![]() CO2(g)+ NO(g) ΔH=227 kJ·mol1
CO2(g)+ NO(g) ΔH=227 kJ·mol1
①寫出CO將NO2還原為單質的熱化學方程式 。
②已知C≡O的鍵能為1076 kJ·mol1、C=O的鍵能為745 kJ·mol1,則使1 mol NO2(g)、1 mol NO(g)分解成相應的原子所需要的能量之差是___________。
(3)向某密閉容器中通入等物質的量的CO、NO,在一定條件下發生如下反應:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH =746 kJ·mol1。測得反應在不同溫度、壓強條件下,平衡混合物中CO2的體積分數如圖1所示。又知該反應的逆反應速率公式為v逆=
N2(g)+2CO2(g) ΔH =746 kJ·mol1。測得反應在不同溫度、壓強條件下,平衡混合物中CO2的體積分數如圖1所示。又知該反應的逆反應速率公式為v逆=
k逆c2(CO2)·c(N2),實驗測得平衡時v逆與c(N2)的關系如圖2所示。
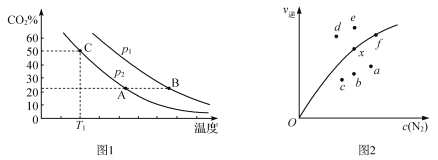
①圖Ⅰ中,A、B兩點對應的平衡常數K(A)_________K(B)(填“>”、“<”或“=”,下同),p1_______p2,C點所對應的反應中N2的產率是_______________。
②圖Ⅱ中,當x點升高到某一溫度時,反應重新達到平衡,則變為相應的點為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】材料是人類生存和社會進步的物質基礎。
(1)鐵是是現代化學工業的基礎,人類進步必不可少的金屬材料。工業上冶煉鐵是在煉鐵高爐內用一氧化碳將氧化鐵還原為金屬鐵。已知:
① 2Fe(s)+ ![]() O2(g)=Fe2O3(s) △H=-824.6kJ/mol
O2(g)=Fe2O3(s) △H=-824.6kJ/mol
② CO(g)+![]() O2(g)= CO2(g) △H=-283.0kJ/mol
O2(g)= CO2(g) △H=-283.0kJ/mol
請寫出煉鐵高爐中冶鐵的熱化學方程式 。
(2)下圖表示一定溫度下,貯氫合金(M)的貯氫過程,縱軸為平衡時氫氣的壓強(p),橫軸表示固相中氫原子與金屬原子個數比(H/M)。當反應處于圖中a點時,保持溫度不變,向恒容體系中通入少量氫氣,達到平衡后反應可能處于圖中的_____點(填“b”“c”或“d”)。10g該合金2min內吸收氫氣500mL,吸氫速率v=______mLg-1min-1。

(3)氮化硅是一種耐高溫陶瓷材料。可用四氯化硅和氮氣在氫氣氣氛保護下,加強熱發生反應,可得較高純度的氮化硅,反應的化學方程式為________。
(4)高氯酸銨(NH4ClO4)是用于導彈和火箭發射推進劑的新材料。傳統制備NH4ClO4的方法是電解NaClO3水溶液得到NaClO4,再與NH4Cl進行復分解反應,經重結晶得到粗產品后,經多步精制、提純得到高純NH4ClO4。新近研究了一種制備高純NH4ClO4的新工藝,其基本方法是用惰性電極電解高純HClO得到高純HClO4,再與高純氨NH3進行噴霧反應制成高氯酸銨。
請回答下列問題:
①寫出由次氯酸電解制備高氯酸的陽極電極反應式: 。
②與傳統工藝相比,你認為新工藝有哪些優點: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2 L容積不變的容器中,發生N2+3H2 ![]() 2NH3的反應。現通入4 mol H2和4 mol N2,10 s內用H2表示的反應速率為0.12 mol/(L·s),則10 s后容器中N2的物質的量是
2NH3的反應。現通入4 mol H2和4 mol N2,10 s內用H2表示的反應速率為0.12 mol/(L·s),則10 s后容器中N2的物質的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com