
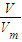 計算混合氣體的物質的量,結合體積分數計算甲烷、氫氣各自物質的量,結合熱化學方程式計算放出的熱量.
計算混合氣體的物質的量,結合體積分數計算甲烷、氫氣各自物質的量,結合熱化學方程式計算放出的熱量.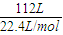 =5mol,
=5mol,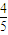 =4mol,完全燃燒生成液體水放出的熱量為(Q1+2Q3)×
=4mol,完全燃燒生成液體水放出的熱量為(Q1+2Q3)× =4(Q1+2Q3),
=4(Q1+2Q3),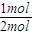 =0.5(Q2+2Q3),
=0.5(Q2+2Q3),

科目:高中化學 來源: 題型:閱讀理解
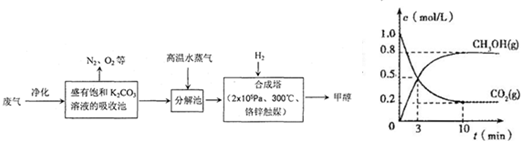
| 一定條件 |
| 一定條件 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
H2(g)+![]() O2(g)
O2(g)![]() H2O(g) ΔH=-
H2O(g) ΔH=-![]() Q2 kJ·mol-1
Q2 kJ·mol-1
H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=-
H2O(l) ΔH=-![]() Q3 kJ·mol-1
Q3 kJ·mol-1
常溫下取體積比為4∶1的甲烷和氫氣的混合氣體
C.0.4Q1+0.1Q3 D.0.4Q1+0.2Q2
查看答案和解析>>
科目:高中化學 來源: 題型:
碳及其含碳化合物在人們的生產生活中應用廣泛。
(1)天然氣是人們日常生活中的清潔能源。
已知①CH4(g)+2O2(g)=CO2(g)+2 H2O(l); △H1=-890.3kJ·mol-1
②2 CO(g)+O2(g)=2CO2 (g); △H2=-566 kJ·mol-1
則反應2 CH4(g)+3O2(g)=2CO(g)+4H2O(l)的△H=_____________。
(2)甲烷燃料電池的化學方程式為CH4+2O2=CO2+2H2O。某甲烷燃料電池以甲烷為燃料,以空氣為氧化劑,以熔融的K2CO3(其中不含O2-和HCO3—)為電解質,以具有催化作用和導電性能的稀土金屬為電極。
該燃料電池的負極電極反應式為:CH4-8e-+4CO32—=5CO2+2H2O,則其正極電極反應式為____________;為使電解質的組成保持穩定,使該燃料電池長時間穩定運行,在通入的空氣中必須加入________________物質。
(3)以該燃料電池為電源,以鉑作電極電解1000g 4.55%的NaOH溶液,一段時間后,溶液中溶質的質量分數變為5.00%,則陽極產生的氣體在標準狀況下的體積為________L。
(4)將不同量的CO(g)和H2O(g)分別通入到體積為2 L的恒容密閉容器中,進行反應CO(g)+H2O(g)CO2(g)+H2(g),得到如下三組數據:
①實驗A中以v(H2)表示的反應速率為___________________。
②通過計算可知,CO的轉化率實驗A_______________實驗B(填“大于”、“等于”或“小于”),該反應的正反應為______________熱反應(填“吸”或“放”)。
③若實驗C要達到與實驗B相同的平衡狀態,則a、b應滿足的關系是_________________(用含a、b的數學式表示)。
查看答案和解析>>
科目:高中化學 來源:2010屆鄭州高中畢業班第三次質量預測理綜化學部分 題型:填空題
碳及其含碳化合物在人們的生產生活中應用廣泛。
(1)天然氣是人們日常生活中的清潔能源。
已知①CH4(g)+2O2(g)=CO2(g)+2 H2O(l); △H1=-890.3kJ·mol-1
②2 CO(g)+O2(g)=2CO2 (g); △H2=-566 kJ·mol-1
則反應2 CH4(g)+3O2(g)=2CO(g)+4H2O(l)的△H=_____________。
(2)甲烷燃料電池的化學方程式為CH4+2O2=CO2+2H2O。某甲烷燃料電池以甲烷為燃料,以空氣為氧化劑,以熔融的K2CO3(其中不含O2-和HCO3—)為電解質,以具有催化作用和導電性能的稀土金屬為電極。
該燃料電池的負極電極反應式為:CH4-8e-+4CO32—=5CO2+2H2O,則其正極電極反應式為____________;為使電解質的組成保持穩定,使該燃料電池長時間穩定運行,在通入的空氣中必須加入________________物質。
(3)以該燃料電池為電源,以鉑作電極電解1000g 4.55%的NaOH溶液,一段時間后,溶液中溶質的質量分數變為5.00%,則陽極產生的氣體在標準狀況下的體積為________L。
(4)將不同量的CO(g)和H2O(g)分別通入到體積為2 L的恒容密閉容器中,進行反應CO(g)+H2O(g) CO2(g)+H2(g),得到如下三組數據:
CO2(g)+H2(g),得到如下三組數據:
①實驗A中以v(H2)表示的反應速率為___________________。
②通過計算可知,CO的轉化率實驗A_______________實驗B(填“大于”、“等于”或“小于”),該反應的正反應為______________熱反應(填“吸”或“放”)。
③若實驗C要達到與實驗B相同的平衡狀態,則a、b應滿足的關系是_________________(用含a、b的數學式表示)。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年河南省原名校高三上學期期聯考化學試卷(解析版) 題型:填空題
Ⅰ.某溶液中僅含下表離予中的5種離子(不考慮水的電離及離子的水解),且各離子的物質的量均相等都為0.0lmol。

①若向原溶液中加入KSCN溶液,無明顯變化。
②若向原溶液中加入過量的鹽酸,有氣體生成.溶液中陰離子種類不變。
③若向原溶液中加入BaCl2溶液,有白色沉淀生成。
試回答下列問題
(1)若先向原溶液中先加入過量的鹽酸,再加入KSCN溶液,現象是__________________。該過程中涉及的離子方程式有________________、__________________。
(2)向原溶液中加入足量的NaOH溶液,充分反應后,過濾、洗滌、灼燒,最終所得固體為____________________(寫化學式)。
(3)向原溶液中加入足量鹽酸后,用排水法收集所產生的氣體并使氣體恰好充滿容器,將容器倒置于水槽中,再向容器中通入___________mLO2(氣體體積均指標準狀況),能使溶液充滿該容器。
Ⅱ.amolCu2S和bmol FeS投入到v L c mol/L的稀硝酸中;充分反應,生成NO氣體,所得澄清溶液可以看作Cu(NO3)2、Fe(NO3)3和H2SO4的混合溶液,則反應中未被還原的硝酸的物質的量為 ___________mol(用同時含有a、b、v、c的表達式表示)。
Ⅲ.已知CH4(g)+2O2(g) CO2(g)+2H2O(l) △H1=a kJ/mol欲計算反應CH4(g)+4NO(g)
CO2(g)+2H2O(l) △H1=a kJ/mol欲計算反應CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(l)的焓變△H2,則還需要查找某反應的焓變△H3,當反應中各物質化學計量數之比為最簡整數比時△H3=b kJ/mol,則該反應的熱化學方程式為______________________________________。
2N2(g)+CO2(g)+2H2O(l)的焓變△H2,則還需要查找某反應的焓變△H3,當反應中各物質化學計量數之比為最簡整數比時△H3=b kJ/mol,則該反應的熱化學方程式為______________________________________。
據此計算出△H2=_____________kJ/mol(用含a和b的式子表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com