
【題目】(1)比較下列粒子的半徑大小
①Na Mg O F __________
②Na+ Mg2+ O2- F-__________
③Fe Fe2+ Fe3+__________
④Na+ Mg2+ S2- Cl-__________
(2)下列物質中:只存在共價鍵的是__________(填序號,下同),只存在離子鍵的是__________,既存在離子鍵又存在極性共價鍵的是__________,既存在離子鍵又存在非極性共價鍵的是__________。
①Ar ②CO2 ③Na2O2 ④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO ⑧H2SO4
(3)氫氣可由天然氣和水反應制備,其主要反應為:CH4(g)+ 2H2O(g) ===CO2(g)+4H2(g) 反應過程中能量變化如圖所示,則該反應為__________反應(填“吸熱”或“放熱”)。若已知,破壞1mol化學鍵需要吸收的熱量如代數式表示:
化學鍵 | C—H | O—H | C=O | H—H |
吸收熱量(kJ/mol) | a | b | c | d |

則根據該反應制取1mol H2要吸收或放出熱量為___________kJ(用含a、b、c、d字母表示)。
【答案】![]()
![]()
![]()
![]() ②⑧ ⑤⑦ ④⑥ ③ 吸熱
②⑧ ⑤⑦ ④⑥ ③ 吸熱 ![]()
【解析】
(1)微粒半徑大小比較的一般規律:一看電子層數、二看核電荷數、三看電子數;
(2)共價鍵:相鄰原子間通過共用電子對形成的化學鍵;離子鍵:陰陽離子通過靜電作用形成的化學鍵;同種元素原子之間形成的非極性共價鍵;不同種元素原子之間形成極性共價鍵;
(3)舊鍵斷裂吸收能量,新鍵形成釋放能量。
(1)①Na和Mg原子核外有3層電子,鈉的質子數小,鈉的半徑大于鎂,O和F原子核外兩層電子,氧的質子數小,氧的半徑大于氟,故答案為:![]() ;
;
②![]() 核外電子排布相同,質子數越大,半徑越小,故答案為:
核外電子排布相同,質子數越大,半徑越小,故答案為:![]() ;
;
③![]() 電子層數相同,都是4層, 電子數越多,半徑越大, 故答案為:
電子層數相同,都是4層, 電子數越多,半徑越大, 故答案為:![]() ;
;
④![]() 核外兩層電子,
核外兩層電子,![]() 核外三層電子,
核外三層電子,![]() 比
比![]() 半徑小,電子層數相同時,質子數越大,半徑越小,故答案為:
半徑小,電子層數相同時,質子數越大,半徑越小,故答案為: ![]() ;
;
(2)①Ar 單原子分子,不存在化學鍵;
②![]() 碳原子和氧原子形成極性共價鍵;
碳原子和氧原子形成極性共價鍵;
③![]() 中鈉離子和過氧根離子間形成離子鍵,過氧根離子內部氧原子之間形成非極性共價鍵;
中鈉離子和過氧根離子間形成離子鍵,過氧根離子內部氧原子之間形成非極性共價鍵;
④KOH中鉀離子和氫氧根離子間形成離子鍵,氫氧根離子內部氧原子、氫原子間形成極性共價鍵;
⑤![]() 鎂離子與溴離子間形成離子鍵;
鎂離子與溴離子間形成離子鍵;
⑥![]() 銨根離子與氯離子間形成離子鍵,銨根離子內部氮原子、氫原子間形成極性共價鍵;
銨根離子與氯離子間形成離子鍵,銨根離子內部氮原子、氫原子間形成極性共價鍵;
⑦CaO鈣離子和氧原子間形成離子鍵;
⑧![]() 氫原子與氧原子之間、氧原子與硫原子間均形成極性共價鍵;
氫原子與氧原子之間、氧原子與硫原子間均形成極性共價鍵;
故答案為:②⑧;⑤⑦;④⑥;③;
(3)根據能量變化圖像,反應物能量比產物能量低,故該反應為吸熱反應;![]() ,該反應中生成4mol氫氣時會斷裂4mol
,該反應中生成4mol氫氣時會斷裂4mol![]() 鍵和4mol
鍵和4mol![]() 鍵,形成2mol
鍵,形成2mol![]() 鍵和4mol
鍵和4mol![]() 鍵,吸收量為
鍵,吸收量為![]() ,故該反應制取1mol H2要吸收
,故該反應制取1mol H2要吸收![]() ,故答案為:
,故答案為:![]() 。
。


 期末好成績系列答案
期末好成績系列答案 99加1領先期末特訓卷系列答案
99加1領先期末特訓卷系列答案 百強名校期末沖刺100分系列答案
百強名校期末沖刺100分系列答案 好成績1加1期末沖刺100分系列答案
好成績1加1期末沖刺100分系列答案 金狀元績優好卷系列答案
金狀元績優好卷系列答案科目:高中化學 來源: 題型:
【題目】常溫下,向1L 0.1 mo1.L-1NH4C1溶液中,不斷加入固體NaOH后,NH4+與NH3·H2O的濃度變化趨勢如圖所示(不考慮溶液體積的變化和氨的揮發),下列說法正確的是

A. M點溶液中水的電離程度比原溶液大
B. 隨著NaOH的加入,NH4+與NH3·H2O物質的量總量減少
C. 當n(NaOH)=0.05mol時,溶液中有:c(C1-)>c(Na+>c(NH4+>c(OH-)>c(H+)
D. 在M點時,n(OH-)+0.05=a+n(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.實驗室用下圖甲所示的裝置制取乙酸乙酯。
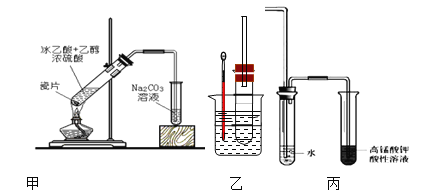
(1)飽和碳酸鈉溶液的作用是:①_____ ;②________;③ ______
(2)右邊裝置中通蒸氣的導管要插在液面上而不能插入溶液中,目的是防止_________
(3)分離得到乙酸乙酯的方法是_________ ,分離需要的玻璃儀器是 _________
(4)在制備乙酸乙酯實驗中通常使用過量的乙醇目的是____________
II溴乙烷在不同溶劑中與NaOH可發生不同類型的反應,生成不同的反應產物。某同學依據溴乙烷的性質,用圖實驗裝置(鐵架臺、酒精燈略)驗證取代反應和消去反應的產物,請你一起參與探究。
(1)圖乙在試管中加入5 mL 1 mol/L NaOH水溶液和5 mL 溴乙烷,
①水浴加熱,優點是_________ 試管口安裝一長導管的作用是___________
②鑒定生成物中乙醇的結構,可用的波譜是_______ 和 __________
(2)圖乙在試管中加入5 mL NaOH乙醇溶液和5 mL 溴乙烷,水浴加熱。
①請寫出該反應的化學方程式______________
②為證明溴乙烷在NaOH乙醇溶液中發生的是消去反應,在設計的實驗方案中,需要檢驗的是____,檢驗的裝置如圖丙所示,在氣體通入酸性高錳酸鉀溶液前加一個盛水的試管,其作用是____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素 W、X、Y、Z原子序數依次增大,W與Y、X與Z位于同一主族,W與X可形成共價化合物 WX2,Y原子內層電子總數是其最外層電子數的2.5倍。下列敘述不正確的是( )
A. WX、WX2、ZX2的化學鍵類型完全相同
B. WZ2分子中所有原子最外層都滿足8電子結構
C. 由于X的常見氫化物(H2X)分子間存在氫鍵,故H2X比H2Z 穩定
D. 原子半徑大小順序為X<W<Z<Y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈦由于其穩定的化學性質,良好的耐高溫、耐低溫、抗強酸、抗強堿以及高強度、低密度,被美譽為“未來鋼鐵”、“戰略金屬”。
(1)基態鈦原子核外共有_______種運動狀態不相同的電子,價電子排布式_______;與鈦同周期的元素中,基態原子的未成對電子數與鈦相同的有________種。
(2)鈦比鋼輕、比鋁硬,是一種新興的結構材料。鈦硬度比鋁大的原因是_________。
(3)TiCl4是氧化法制取鈦的中間產物。TiCl4分子結構與CCl4相同,在常溫下都是液體。TiCl4分子的空間構型是_______;TiCl4穩定性比CCl4差,試從結構分析其原因:_______。
(4)鈣鈦礦材料是一類有著與鈦酸鈣相同晶體結構的材料,這種奇特的晶體結構讓它具備了很多獨特的理化性質,比如吸光性、電催化性等。鈦酸鈣晶體結構如圖所示。其中,A代表Ca2+,Ti原子位于由O原子構成的正八面體的中心,則鈦酸鈣的化學式為______,Ca2+的配位數是________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組中的反應,屬于同一反應類型的是
A. 由溴丙烷水解制丙醇;由丙烯與水反應制丙醇
B. 由甲苯硝化制對硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代環己烷消去制環己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知高能鋰電池的總反應式為:2Li+FeS=Fe+Li2S[LiPF6SO(CH3)2為電解質],用該電池為電源進行如圖的電解實驗,電解一段時間測得甲池產生標準狀況下H24.48L。下列有關敘述不正確的是
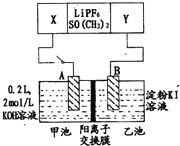
A.從隔膜中通過的離子數目為0.4NA
B.若電解過程體積變化忽略不計,則電解后甲池中溶液濃度為4mol/L
C.A電極為陽極
D.電源正極反應式為:FeS+2Li++2e-=Fe+Li2S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知(Ⅰ)、(Ⅱ)反應在一定條件下焓變及平衡常數如下:
2H2(g)+S2(g)2H2S(g) ΔH1 K1 (Ⅰ)
3H2(g)+SO2(g)2H2O(g)+H2S(g) ΔH2 K2 (Ⅱ)
(1)用ΔH1、ΔH2表示反應4H2(g)+2SO2(g)=S2(g)+4H2O(g)的ΔH=________。
(2)回答下列反應(Ⅰ)的相關問題:
①溫度為T1,在1 L恒容容器中加入1.8 mol H2、1.2 mol S2,10 min時反應達到平衡。測得10 min內v(H2S)=0.08 mol·L-1·min-1,則該條件下的平衡常數為________。
②溫度為T2時(T2>T1),在1 L恒容容器中也加入1.8 mol H2、1.2 mol S2,建立平衡時測得S2的轉化率為25%,據此判斷ΔH1________0(填“>”或“<”),與T1時相比,平衡常數K1__(填“增大”“減小”或“不變”)。
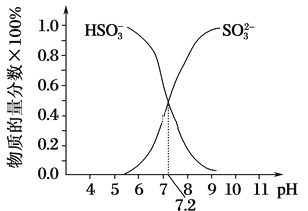
(3)常溫下,用SO2與NaOH溶液反應可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液顯堿性,原因是________________(寫出主要反應的離子方程式),該溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物質的量分數隨pH變化曲線如圖所示(部分),根據圖示,則SO32-的水解平衡常數=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關Na2CO3 和NaHCO3的說法錯誤的是
A. 等質量Na2CO3 和NaHCO3分別和足量鹽酸反應,相同條件下前者生成CO2少
B. 將石灰水分別加入NaHCO3和Na2CO3中,前者不生成沉淀
C. 相同條件下Na2CO3 比NaHCO3更易溶于水
D. Na2CO3 固體中含少量NaHCO3,可用加熱法除去
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com