
(14分) 能源短缺是人類面臨的重大問題。甲醇是一種可再生能源,具有廣泛的開發和應用前景。(1)工業上一般采用下列兩種反應合成甲醇:
反應I:CO2(g)+3H2(g)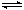 CH3OH(g)+H2O(g)ΔH1 反應II:CO(g)+2H2(g)
CH3OH(g)+H2O(g)ΔH1 反應II:CO(g)+2H2(g)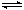 CH3OH(g)
ΔH2
CH3OH(g)
ΔH2
① 上述反應符合“原子經濟”原則的是 (填“Ⅰ”或“Ⅱ”),
② 下表所列數據是反應Ⅱ在不同溫度下的化學平衡常數(K)的變化
|
溫度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
I.由表中數據判斷ΔH2 0(填“>”、“<”或“=”),
Ⅱ.若容器容積不變,下列措施可增加甲醇產率的是 ,
A.升高溫度 B.將CH3OH(g)從體系中分離 C.使用合適的催化劑 D.充入He,使體系總壓強增大 E.按原比例再充入 CO和 H2
Ⅲ.某溫度下,將2 mol CO和6 mol H2充入2L的密閉容器中,充分反應,達到平衡后,測得c(CO)=0.2 mol·L-1,則CO的轉化率為 ,此時的溫度為 (從上表中選擇);
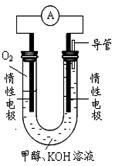
(2)某實驗小組依據甲醇燃燒的反應原理,設計如上圖所示的原電池裝置。
① 該電池工作時,OH-向_______極移動(填“正”或“負”),
② 該電池負極的電極反應為 。
考查綠色化學的思想、外界條件對平衡的影響以及電化學的應用等。
(1)①Ⅱ ② I.< Ⅱ.BE Ⅲ.80% 250℃ (2)① 負
②CH3OH +8OH-— 6e- = CO3 2- + 6H2O
【解析】(1)原子利用率達到100%的即符合綠色化學原則,所以反應Ⅱ符合“原子經濟”原則;根據表中數據可判斷,隨著溫度的升高,平衡常數逐漸減小,說明升高溫度平衡向逆反應方向移動,所以正反應是放熱反應,即△H<0;升高溫度平衡向逆反應方向移動,生成物的產率降低,A不正確。B相當于降低生成物濃度,平衡向逆反應方向移動,增大產率,正確。催化劑只影響反應速率,不影響平衡狀態,C不正確。D只壓強增大,但反應物的濃度并沒有增大,平衡不移動,不正確。E相當于增大反應物的濃度平衡平衡向正反應方向移動,產率增大。
(2)原電池中負極失去電子,經導線傳遞到正極上,正極得到電子,所以溶液中的陽離子向正極移動,而陰離子向負極移動。根據燃料電池的裝置圖可判斷通入氧氣的電極是正極,甲醇在負極通入,由于電解質是氫氧化鉀溶液顯強堿性,所以甲醇的氧化產物是碳酸鉀和水。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
(14分) 能源短缺是人類面臨的重大問題。甲醇是一種可再生能源,具有廣泛的開發和應用前景。(1)工業上一般采用下列兩種反應合成甲醇:
反應I:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH1 反應II:CO(g)+2H2(g)
CH3OH(g) ΔH2
① 上述反應符合“原子經濟”原則的是 (填“Ⅰ”或“Ⅱ”),
② 下表所列數據是反應Ⅱ在不同溫度下的化學平衡常數(K)的變化
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
I.由表中數據判斷ΔH2 0(填“>”、“<”或“=”),
Ⅱ.若容器容積不變,下列措施可增加甲醇產率的是 ,
A.升高溫度 B.將CH3OH(g)從體系中分離 C.使用合適的催化劑 D.充入He,使體系總壓強增大 E.按原比例再充入 CO和 H2
Ⅲ.某溫度下,將2 mol CO和6 mol H2充入2L的密閉容器中,充分反應,達到平衡后,測得c(CO)=0.2 mol·L-1,則CO的轉化率為 ,此時的溫度為 (從上表中選擇);
(2)某實驗小組依據甲醇燃燒的反應原理,設計如上圖所示的原電池裝置。
① 該電池工作時,OH-向_______極移動(填“正”或“負”),
② 該電池負極的電極反應為 。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年四川省成都市樹德協進中學高二5月月考化學試卷(帶解析) 題型:填空題
(14分) 能源短缺是人類面臨的重大問題。甲醇是一種可再生能源,具有廣泛的開發和應用前景。(1)工業上一般采用下列兩種反應合成甲醇:
反應I:CO2(g)+3H2(g)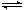 CH3OH(g)+H2O(g)ΔH1 反應II:CO(g)+2H2(g)
CH3OH(g)+H2O(g)ΔH1 反應II:CO(g)+2H2(g)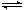 CH3OH(g) ΔH2
CH3OH(g) ΔH2
①上述反應符合“原子經濟”原則的是 (填“Ⅰ”或“Ⅱ”),
②下表所列數據是反應Ⅱ在不同溫度下的化學平衡常數(K)的變化
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com