
【題目】國家實施“青山綠水工程”,大力研究脫硝和脫硫技術。
(1)H2在催化劑作用下可將NO還原為N2。如圖是該反應生成1 mol水蒸氣的能量變化示意圖。寫出該反應的熱化學方程式__________。

(2)2NO(g)+O2(g)![]() 2NO2(g)的反應歷程如下:
2NO2(g)的反應歷程如下:
反應Ⅰ:2NO(g)![]() N2O2(g)(快) ΔH1<0,v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
N2O2(g)(快) ΔH1<0,v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
反應Ⅱ:N2O2(g)+O2(g)![]() 2NO2(g)(慢)ΔH2<0,v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2(NO2)。
2NO2(g)(慢)ΔH2<0,v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2(NO2)。
①一定條件下,反應2NO(g)+O2(g)![]() 2NO2(g)達到平衡狀態,平衡常數K=___________(用含k1正、k1逆、k2正、k2逆的代數式表示)。反應Ⅰ的活化能EⅠ___________(填“>”“<”或“=”)反應Ⅱ的活化能EⅡ。
2NO2(g)達到平衡狀態,平衡常數K=___________(用含k1正、k1逆、k2正、k2逆的代數式表示)。反應Ⅰ的活化能EⅠ___________(填“>”“<”或“=”)反應Ⅱ的活化能EⅡ。
②已知反應速率常數k隨溫度升高而增大,則升高溫度后k2正增大的倍數__________(填“大于”“小于”或“等于”)k2逆增大的倍數。
(3)我國科學家在天然氣脫硫研究方面取得了新進展,利用如圖裝置可發生反應:H2S+O2=H2O2+S↓。
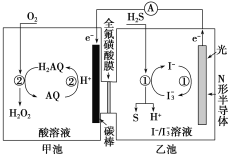
①裝置中H+向_______池遷移。
②乙池溶液中發生反應的離子方程式:_______。
(4)廢水處理時,通H2S(或加S2-)能使某些金屬離子生成極難溶的硫化物而除去。25 ℃,某廢液中c(Mn2+)=0.02 mol·L-1,調節廢液的pH使Mn2+開始沉淀為MnS時,廢液中c(H2S)=0.1 mol·L-1,此時pH約為_______(已知:Ksp(MnS)=5.0×10-14,H2S的電離常數:Ka1=1.5×10-7,Ka2=6.0×10-15,lg 6=0.8)。
【答案】2H2(g)+2NO(g)=N2(g)+2H2O(g) ΔH=2(E1-E2)kJ·mol-1 或2H2(g)+2NO(g)=N2(g)+2H2O(g) ΔH=-2(E2-E1)kJ·mol-1或H2(g)+NO(g)=![]() N2(g)+H2O(g) ΔH=(E1-E2)kJ·mol-1或H2(g)+NO(g)=
N2(g)+H2O(g) ΔH=(E1-E2)kJ·mol-1或H2(g)+NO(g)=![]() N2(g)+H2O(g) ΔH=-(E2-E1)kJ·mol-1
N2(g)+H2O(g) ΔH=-(E2-E1)kJ·mol-1 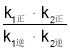 < 小于 甲 H2S+I3-=3I-+S↓+2H+ 5.2
< 小于 甲 H2S+I3-=3I-+S↓+2H+ 5.2
【解析】
(1)根據能量變化圖,反應熱=正反應的活化能-逆反應的活化能,再根據熱化學反應方程式的書寫解答;
(2)①2NO(g)N2O2(g)①;②N2O2(g)+O2(g)2NO2(g)②,根據蓋斯定律,①+②得2NO(g)+O2(g)2NO2(g),平衡常數K=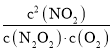 ,由反應達平衡狀態,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆;因為決定2NO(g)+O2(g)2NO2(g)速率的是反應②,所以反應①的活化能E1遠小于反應②的活化能E2;
,由反應達平衡狀態,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆;因為決定2NO(g)+O2(g)2NO2(g)速率的是反應②,所以反應①的活化能E1遠小于反應②的活化能E2;
②根據應②為放熱反應,溫度升高平衡向著逆向移動分析;
(3)①原電池中陽離子移向正極;
②在乙池中,硫化氫失電子生成硫單質,碘單質得電子生成I-,據物質的變化確定發生的反應;
(4)當Qc=Ksp(MnS)時開始沉淀,由此求出硫離子的濃度,結合Ka1×Ka2=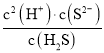 =1.5×10-7×6.0×10-15=9.0×10-22計算出c(H+),然后可計算出溶液的pH。
=1.5×10-7×6.0×10-15=9.0×10-22計算出c(H+),然后可計算出溶液的pH。
(1)正反應活化能為E3-E2 ,逆反應活化能為E3-E1;生成1 mol水蒸氣,該反應的反應熱為ΔH=(E3-E2)-(E3-E1)=(E1-E2)kJ·mol-1,所以該反應的熱化學方程式:H2(g)+NO(g)=![]() N2(g)+H2O(g) ΔH=(E1-E2)kJ·mol-1或為2H2(g)+2NO(g)=N2(g)+2H2O(g) ΔH=2(E1-E2) kJ·mol-1;
N2(g)+H2O(g) ΔH=(E1-E2)kJ·mol-1或為2H2(g)+2NO(g)=N2(g)+2H2O(g) ΔH=2(E1-E2) kJ·mol-1;
(2)①Ⅰ:2NO(g) N2O2(g)(快);v1正=k1正·c2(NO);v1逆=k1逆·c(N2O2) ΔH1<0;
Ⅱ:N2O2(g)+O2(g) 2NO2(g)(慢);v2正=k2正·c(N2O2)·c(O2);v2逆=k2逆·c2(NO2) ΔH2<0;由反應達平衡狀態,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正·c2(NO)×k2正·c(N2O2)·c(O2)=k1逆·c(N2O2)× k2逆·c2(NO2),則有K=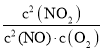 =
=![]() ;因為決定2NO(g)+O2(g) 2NO2(g)速率的是反應Ⅱ,所以反應Ⅰ的活化能EⅠ遠小于反應Ⅱ的活化能EⅡ;
;因為決定2NO(g)+O2(g) 2NO2(g)速率的是反應Ⅱ,所以反應Ⅰ的活化能EⅠ遠小于反應Ⅱ的活化能EⅡ;
②k隨溫度升高而增大,則升高溫度后k2正增大的倍數小于k2逆增大的倍數;
(3)①從示意圖中看出,電子流向碳棒一極,該極為正極,氫離子從乙池移向甲池;
②乙池溶液中,硫化氫與I3-發生氧化還原反應:硫化氫失電子變為硫單質,I3-得電子變為I-,離子反應為H2S+I3-=3I-+S↓+2H+;
(4)25 ℃,某廢液中c(Mn2+)=0.02 mol·L-1,調節廢液的pH使Mn2+開始沉淀為MnS時,c(S2-)=![]() =
=![]() =2.5×10-12 mol·L-1,
=2.5×10-12 mol·L-1,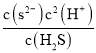 =Ka1×Ka2,c(H+)=
=Ka1×Ka2,c(H+)=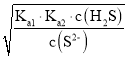 =
=![]() =6×10-6 mol·L-1,pH=5.2。
=6×10-6 mol·L-1,pH=5.2。


 好成績1加1期末沖刺100分系列答案
好成績1加1期末沖刺100分系列答案 金狀元績優好卷系列答案
金狀元績優好卷系列答案科目:高中化學 來源: 題型:
【題目】已知A、B、C、D、E是元素周期表中1~36號元素,其原子序數依次增大,且A、B、C、D為主族元素。A與另外四種元素既不在同一周期,也不在同一主族。B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外層電子數與最內層電子數相同,D跟B可形成離子化合物,其晶胞結構(其中B原子在晶胞內部)如圖。
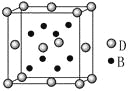
請回答下列問題:
(1)C-的電子排布式為_______;E元素原子的價電子排布式為________。
(2)元素B與氮元素可以形成化合物NB3,其中N-B鍵的化學鍵類型為________,根據價層電子對互斥理論可以判斷NB3的空間構型為________,NB3分子中N原子的雜化方式為________雜化。
(3)A、B形成的化合物AB的相對分子質量比A、C形成的化合物AC的相對分子質量小,但AB的沸點比AC高,其原因是_________________________。
(4)從晶胞圖可以得出:D與B形成的離子化合物的化學式為______________。
(5)含有D元素的化合物焰色反應為______色,焰色反應的原理是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮氧化物(用NOx表示)是大氣污染的重要因素,根據NOx的來源和性質特點,已開發出多種化學治理其污染的方法。
(1)汽車尾氣中的NO2是城市大氣污染的主要污染物之一。在日光照射下,NO2發生一系列光化學煙霧的循環反應,從而不斷產生O3,加重空氣污染。反應過程為①2NO2→2NO+2O,②2NO+O2→2NO2,③O+O2→O3。下列關于該反應過程及生成物的敘述正確的是____(填序號)。
A.NO2起催化作用
B.NO起催化作用
C.NO2只起氧化作用
D.O3與O2互為同素異形體
(2)汽車尾氣中的CO來自于____,NO來自于____。
(3)汽車尾氣中的CO、NOx可在適宜溫度下采用催化轉化法處理,使它們相互反應生成參與大氣循環的無毒氣體。寫出NO被CO還原的化學方程式:_____。
(4)工業尾氣中氮氧化物常采用堿液吸收法處理。NO2被燒堿溶液吸收時,生成兩種鈉鹽,其物質的量之比為1∶1,該反應的離子方程式為____;1molNO2被完全吸收時,轉移電子的物質的量為____。NO與NO2按物質的量之比1∶1被足量NaOH溶液完全吸收后只得到一種鈉鹽,該鈉鹽的化學式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃,兩種酸的電離平衡常數如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)HSO![]() 的電離平衡常數表達式K=______________________________。
的電離平衡常數表達式K=______________________________。
(2)H2SO3溶液和NaHCO3溶液反應的主要離子方程式為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、W的原子序數依次增大,它們的原子最外層電子數為互不相等的奇數。X與Y位于不同周期,X與W的最高化合價之和為8,元素Z的單質是目前使用量最大的主族金屬元素單質。下列說法中正確的是
A. 化合物YX4W溶于水后,得到的溶液呈堿性
B. 化合物YW3為共價化合物,電子式為![]()
C. Y、Z形成的一種化合物強度高,熱膨脹系數小,是良好的耐熱沖擊材料
D. 原子半徑大小:W>Z>Y>X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計如圖所示實驗,探究反應中的能量變化。
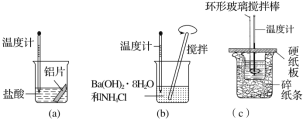
下列判斷正確的是( )
A.由實驗可知,(a)、(b)、(c)所涉及的反應都是放熱反應
B.將實驗(a)中的鋁片更換為等質量的鋁粉后釋放出的熱量有所增加
C.實驗(c)中將環形玻璃攪拌棒改為鐵質攪拌棒對實驗結果沒有影響
D.若用NaOH固體測定中和熱,則測定中和熱的數值偏高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO和H2被稱為合成氣,用合成氣可以合成乙酸。回答下列問題:
(1)已知CO、H2、CH3COOH的燃燒熱ΔH分別為-283.0kJ/mol、-285.8kJ/mol、-1255.0kJ/mol,則用合成氣合成CH3COOH(l)的可逆過程的熱化學反應方程式為___________________________________________;
(2)在密閉容器中發生合成乙酸的反應,下列可以提高CH3COOH產率的措施有________。
A.恒溫恒容,通入少量氦氣 B.及時分離出產物乙酸
C.加入高效催化劑 D.壓縮容器體積
(3)在150℃時,2L的密閉容器中發生反應:
2H2(g)+2CO(g)![]() CH3COOH(g) ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的濃度數據隨時間變化如下表所示:
CH3COOH(g) ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的濃度數據隨時間變化如下表所示:
時刻/min | 0 | 2 | 4 | 6 | 8 |
c(CH3COOH)/mol/L | 0 | 0.3 | 0.5 | 0.6 | 0.6 |
①0~2min內用CO表示該反應的速率為_________________,隨著反應的進行速率逐漸減慢的可能原因是____________________________________________________;
②150℃時該反應的平衡常數的數值約為_________;(計算結果保留一位小數)
③平衡后再通入1molH2,則CH3COOH(g)的體積分數________,若再次通入1molH2和1molCO,則CH3COOH(g)的體積分數_________。(填“增大”“減小”或者“不變”)
(4)一定溫度下,容積恒為1L的兩個密閉容器之中進行如下實驗:
實驗編號 | 起始投料 |
① | 2molH2和2molCO |
② | 1molCH3COOH(g) |
則實驗①中H2和實驗②中CH3COOH的轉化率隨時間變化圖示如下:
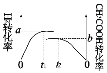
則a+b=_______,達到平衡的時間大小關系為t1__________t2。(填“>”“<”“不確定”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第20屆中國國際工業博覽會上,華東師范大學帶來的一種“鋅十碘”新型安全動力電池亮相工博會高校展區。該新型安全動力電池無污染、高安全、長壽命且具有合適的充電時間,可以應用于日常生活、交通出行等各個領域。已知該電池的工作原理如圖所示。下列有關說法正確的是( )
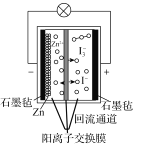
A.正極反應式為I3--2e-=3I-
B.6.5gZn溶解時,電解質溶液中有0.2mol電子移動
C.轉移1mol電子時,有1molZn2+從左池移向右池
D.“回流通道”可以減緩電池兩室的壓差,避免電池受損
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,FeS的Ksp=6.25×10-18(設飽和溶液的密度為1g/mL)。若已知H2S飽和溶液在常溫下,c(H+)與c(S2-)之間存在以下關系:c2(H+)·c(S2-)=1.0×10-22,在該溫度下,將適量FeS投入H2S飽和溶液中,欲使溶液中c(Fe 2+)達到1mol/L,應調節溶液的pH為___________
(已知:lg2 = 0.3)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com