
| A. | Ki1的表達式為Ki1=$\frac{c({H}_{2}C{O}_{3})}{C({H}^{+})•C(HC{{O}_{3}}^{-})}$ | |
| B. | Ki2對應的電離過程是HCO3-+H2O≒H2CO3+OH- | |
| C. | 當碳酸的電離平衡正向移動時,Ki1與Ki2均相應增大 | |
| D. | 改變條件使Ki1減小,則Ki2一定也減小 |
分析 A、Ki1的表達式為Ki1=$\frac{c({H}^{+})c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$;
B、Ki2對應的電離過程是HCO3-+H2O≒CO32-+H3O+;
C、Ki1與Ki2是溫度的函數;
D、電離過程是吸熱過程,要使Ki1減小,只能是降溫,所以Ki2一定減小;
解答 解:A、Ki1的表達式為Ki1=$\frac{c({H}^{+})c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$,故A錯誤;
B、Ki2對應的電離過程是HCO3-+H2O≒CO32-+H3O+,而HCO3-+H2O≒H2CO3+OH-,是碳酸氫根離子的水解反應方程式,故B錯誤;
C、Ki1與Ki2是溫度的函數,與反應進行的方向無關,故C錯誤;
D、電離過程是吸熱過程,要使Ki1減小,只能是降溫,所以Ki2一定減小,故D正確;
故選D.
點評 本題考查了弱電解質的電離,學生要清楚電離子常數表達式的書寫、影響因素是解本題關鍵,難度中等.


科目:高中化學 來源: 題型:選擇題
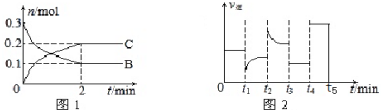
| A. | x=2.反應開始2min內,v(A)=0.05 mol•L-1•min-1 | |
| B. | 若tl時改變的條件是降溫,平衡正向移動,則該反應為放熱反應 | |
| C. | 若t2時改變的條件是增大c的濃度,則t2時正反應速率減小 | |
| D. | t3-t5時間段B的濃度一定未發生變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定等于0.01 | B. | 一定大于0.01 | ||
| C. | 一定大于或等于0.01 | D. | 可能小于0.01 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 理論上講,任何自發的氧化還原反應都可以設計成原電池.
理論上講,任何自發的氧化還原反應都可以設計成原電池.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH4 | B. | C3H4 | C. | C2H4 | D. | C4H8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ①③④ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  1 mol甲分子內含有10 mol共價鍵 | |
| B. |  由乙分子構成的物質不能發生氧化反應 | |
| C. |  丙分子的二氯取代產物只有三種 | |
| D. |  分子丁顯然是不可能合成的 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2為0.4mol/L,O2為0.2mol/L | B. | SO2為0.15mol/L | ||
| C. | SO2,SO3均為0.25mol/L | D. | SO3為0.4mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com