
【題目】甲烷、乙烯、乙醇都是重要的有機化合物。請回答下列問題:
(1)甲烷與氯氣的第一步取代反應(yīng)的化學方程式為____。
(2)把乙烯通入到溴的四氯化碳溶液中,充分振蕩、靜置,觀察到溴的四氯化碳溶液褪色,寫出該過程中發(fā)生反應(yīng)的化學方程式___。
(3)下列幾組物質(zhì)中,互為同分異構(gòu)體的是___,互為同位素的是___,互為同素異形體的是______,屬于同一種物質(zhì)的是__。
A.甲烷與新戊烷 B.氧氣和臭氧 C.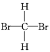 和
和![]() D.35Cl和37Cl E.CH3CH2OH和CH3OCH3
D.35Cl和37Cl E.CH3CH2OH和CH3OCH3
【答案】CH4+Cl2![]() CH3Cl+HCl CH2=CH2+Br2→CH2BrCH2Br E D B C
CH3Cl+HCl CH2=CH2+Br2→CH2BrCH2Br E D B C
【解析】
(1)烷烴發(fā)生取代反應(yīng)是逐步進行的,據(jù)此書寫反應(yīng)方程式。
(2)乙烯與溴單質(zhì)發(fā)生加成反應(yīng)產(chǎn)生1,2-二溴乙烷;
(3)同分異構(gòu)體是分子式相同、結(jié)構(gòu)不同的化合物;同位素是質(zhì)子數(shù)相同而中子數(shù)不同的不同核素;同素異形體是由同種元素組成的不同性質(zhì)的單質(zhì);同一種物質(zhì)就是結(jié)構(gòu)、性質(zhì)完全一樣的物質(zhì)。
(1)甲烷與氯氣在光照條件下發(fā)取代反應(yīng),第一步取代產(chǎn)生一氯甲烷和HCl,反應(yīng)方程式為CH4+Cl2![]() CH3Cl+HCl,反應(yīng)產(chǎn)生的CH3Cl會進一步發(fā)生取代反應(yīng),產(chǎn)生CH2Cl2、CHCl3、CCl4,答案為:CH4+Cl2
CH3Cl+HCl,反應(yīng)產(chǎn)生的CH3Cl會進一步發(fā)生取代反應(yīng),產(chǎn)生CH2Cl2、CHCl3、CCl4,答案為:CH4+Cl2![]() CH3Cl+HCl;
CH3Cl+HCl;
(2)乙烯分子中含有碳碳雙鍵,通入溴的四氯化碳溶液中,與溴發(fā)生加成反應(yīng),產(chǎn)生1,2-二溴乙烷,反應(yīng)方程式為CH2=CH2+Br2→CH2BrCH2Br,答案為:CH2=CH2+Br2→CH2BrCH2Br;
(3)A.甲烷與新戊烷都是烷烴,屬于同系物;
B.氧氣與臭氧是由同一元素組成的不同單質(zhì),互為同素異形體;
C.由于甲烷是正四面體結(jié)構(gòu),任何兩個化學鍵都相鄰,因此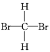 和
和![]() 這兩個結(jié)構(gòu)表示的是同一物質(zhì);
這兩個結(jié)構(gòu)表示的是同一物質(zhì);
D.35Cl和37Cl是表示的是氯元素的兩種原子,質(zhì)子數(shù)相同而中子數(shù),互為同位素;
E.CH3CH2OH和CH3OCH3分子式相同,結(jié)構(gòu)不同,互為同分異構(gòu)體;
故互為同分異構(gòu)體的是E;互為同位素的是D;同素異形體的是B,屬于同一種物質(zhì)的是C,答案為:E;D;B;C。


科目:高中化學 來源: 題型:
【題目】文獻表明:工業(yè)上,向熾熱鐵屑中通入HCl生產(chǎn)無水FeCl2;相同條件下,草酸根(C2O42-)的還原性強于Fe2+。某化學研究性小組進行以下實驗檢驗這一結(jié)論并測定三草酸合鐵酸鉀晶體[K3Fe(C2O4)3xH2O]中草酸根含量和結(jié)晶水含量。用如圖所示裝置制取無水FeCl2

(1)儀器a的名稱為____,B中的試劑為________。
(2)欲制得純凈的FeCl2,實驗過程需先點燃A處酒精燈,原因是________。
(3)若用D的裝置進行尾氣處理,存在的問題是________、________。
(4)某小組設(shè)計使用如圖裝置直接比較Fe2+和C2O42-的還原性強弱,并達到了預期的目的。

左池石墨電極為___極,寫出右池電極反應(yīng)式:________。
(5)為測定三草酸合鐵酸鉀晶體中草酸根的含量和結(jié)晶水的含量,進行了如下實驗:
滴定過程:①稱量mg三草酸合鐵酸鉀晶體樣品,配制成250mL溶液
②取所配溶液25.00mL于錐形瓶中,滴加酸性KMnO4溶液滴定,恰好消耗VmLamolL-1KMnO4溶液。C2O42-被全部轉(zhuǎn)化的現(xiàn)象是___。
③該晶體中C2O42-的質(zhì)量分數(shù)為___。
誤差若盛放酸性KMnO4溶液的滴定管未用標準液潤洗,會使結(jié)晶水x的數(shù)值___。(填“偏高”“偏低”“無影響”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,可逆反應(yīng)C(s)+CO2(g)![]() 2CO(g),達到平衡狀態(tài),現(xiàn)進行如下操作:①升高反應(yīng)體系的溫度;②增加反應(yīng)物C的用量;③縮小反應(yīng)體系的體積:④減少體系中CO的量。上述措施中一定能使反應(yīng)的正反應(yīng)速率顯著加快的是( )
2CO(g),達到平衡狀態(tài),現(xiàn)進行如下操作:①升高反應(yīng)體系的溫度;②增加反應(yīng)物C的用量;③縮小反應(yīng)體系的體積:④減少體系中CO的量。上述措施中一定能使反應(yīng)的正反應(yīng)速率顯著加快的是( )
A.①②③④B.①③
C.④②D.①③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E為原子序數(shù)依次增大的五種短周期主族元素,其中僅含有一種金屬元素,A單質(zhì)是自然界中密度最小的氣體,A和D最外層電子數(shù)相同;C和B、E在周期表中均相鄰,且C、E同主族.B、C的最外層電子數(shù)之和等于D的原子核外電子數(shù),A和C可形成A2C和A2C2兩種常見的液態(tài)化合物.請回答下列問題:
(1)A元素的名稱是____________,D在周期表中的位置____________,E的離子結(jié)構(gòu)示意圖____________。
(2)B2分子的電子式:____________,A2C的結(jié)構(gòu)式:____________,A2C2中的化學鍵類型有:____________(極性鍵、非極性鍵或離子鍵)。
(3)用電子式表示D2E化合物的形成過程為______。
(4)用含A元素最簡單的有機化合物與赤熱的氧化銅反應(yīng)生成一種單質(zhì)、液態(tài)氧化物和一可以使澄清石灰水變渾濁的氣體,其化學方程式為________。
(5)在100mL 18mol/L E的最高價氧化物對應(yīng)水化物的溶液中加入過量的銅片,加熱使之充分反應(yīng),銅片部分溶解,產(chǎn)生的氣體在標準狀況下的體積可能是________(填序號)。
a 7.32L b 6.72L c 20.16L d 30.24L.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25 ℃時,將 0.10 mol·L-1 CH3COOH 溶液滴加到 10 mL 0.10 mol·L-1 NaOH 溶液中,lg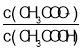 與pH 的關(guān)系如圖所示,C 點坐標是(6,1.7)。下列說法不正確的是
與pH 的關(guān)系如圖所示,C 點坐標是(6,1.7)。下列說法不正確的是
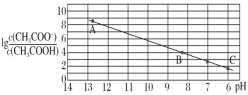
A.pH=7 時加入的醋酸溶液的體積大于 10 mL
B.C 點后繼續(xù)加入醋酸溶液,水的電離程度減小
C.B 點存在 c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
D.Ka(CH3COOH)=10-4.3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的一部分,請參照元素①-⑨在表中的位置,用化學用語回答下列問題:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半徑最小的元素是___(填元素名稱),寫出⑧的原子結(jié)構(gòu)示意圖____________。
(2)最高價氧化物對應(yīng)的水化物中,堿性最強的是___(用化學式回答,下同),酸性最強的是____。
(3)①與⑤形成的化合物中,化學鍵類型為____。
(4)⑦與⑨形成的化合物的電子式為__,②與④形成的原子個數(shù)比為1:2的化合物的結(jié)構(gòu)式為__。
(5)①與②形成的一種烴,具有平面正六邊形結(jié)構(gòu),相對分子質(zhì)量為78,寫出此烴發(fā)生取代反應(yīng)的化學方程式(任寫一個即可):_。
(6)為探究元素②和⑧的非金屬性強弱,某同學設(shè)計了如圖所示的裝置進行實驗(夾持儀器已略去,裝置氣密性良好)。請回答:
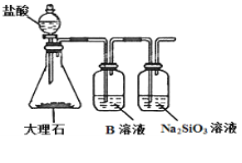
①溶液B為______,B溶液的作用是______。
②若看到_______現(xiàn)象,即可證明酸性_______(用化學式回答),則非金屬性______(用元素符號回答)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】濃差電池有多種:一種是利用物質(zhì)氧化性或還原性強弱與濃度的關(guān)系設(shè)計的原電池(如圖1):一種是根據(jù)電池中存在濃度差會產(chǎn)生電動勢而設(shè)計的原電池(如圖2)。圖1所示原電池能在一段時間內(nèi)形成穩(wěn)定電流;圖2所示原電池既能從濃縮海水中提取LiCl,又能獲得電能。下列說法錯誤的是
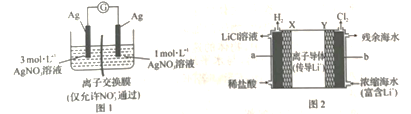
A.圖1電流計指針不再偏轉(zhuǎn)時,左右兩側(cè)溶液濃度恰好相等
B.圖1電流計指針不再偏轉(zhuǎn)時向左側(cè)加入NaCl或AgNO3或Fe粉,指針又會偏轉(zhuǎn)且方向相同
C.圖2中Y極每生成1 mol Cl2,a極區(qū)得到2 mol LiCl
D.兩個原電池外電路中電子流動方向均為從右到左
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在0.l mol·L-1的CH3COOH溶液中存在電離平衡:CH3COOH![]() CH3COO-+H+對于該平衡,下列敘述正確的是
CH3COO-+H+對于該平衡,下列敘述正確的是
A. 加入少量CH3COONH4固體,平衡不移動,c(H+)不變
B. 加入少量NaOH固體,平衡向正向移動,溶液中c(H+)減小
C. 加水,平衡向正向移動,c(CH3COOH)/ c(CH3COO-)增大
D. 通入少量 HCl氣體,平衡逆向移動,溶液中c(H+)減少
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量Na2CO3、NaHCO3組成的混合物溶于水配成50 mL溶液,逐滴加入稀鹽酸,得到各成分物質(zhì)的量變化如圖所示(忽略溶液混合導致的體積變化,已知1 mol=1000 mmol)。
下列說法不正確的是
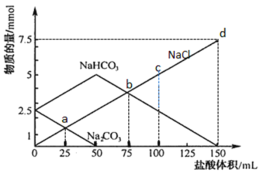
A.鹽酸的物質(zhì)的量濃度為0.05 mol·L-1
B.c點溶液中c(NaCl)=0.05 mol·L-1
C.a點溶液中發(fā)生反應(yīng)的離子方程式為:CO![]() + H+ = HCO
+ H+ = HCO![]()
D.b點和d點所處的溶液中n(Na+)相等
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com