
 3Z(g)△H<O
3Z(g)△H<O| c3(z) |
| c(x)?c2(y) |
| c3(z) |
| c(x)?c2(y) |
| c3(z) |
| c(x)?c2(y) |
| c3(z) |
| c(x)?c2(y) |


 舉一反三期末百分沖刺卷系列答案
舉一反三期末百分沖刺卷系列答案科目:高中化學 來源: 題型:閱讀理解
| 時間/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol?L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
| N2 | H2 | NH3 | |
| 起始濃度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡濃度(mol/L) | a | b | c |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
已知:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol,這是目前普遍使用的人工固氮的方法。請回答下列問題:
(1)450℃時,往一個2L的密閉容器中充入2. 6mol H2和1mol N2, 反應過程中對NH3的濃度進行檢測,得到的數據如下表所示:
| 時間/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L—1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①5 min內,消耗N2的平均反應速率為_______________,此條件下該反應的化學平衡常數K=_______________;反應達到平衡后,若往平衡體系中加入H2、N2和NH3各2mol,此時該反應的v(N2)正_______________v(N2)逆(填寫“>”、“=”或“<”=)。
②下列各項能作為判斷該反應達到化學平衡狀態的依據是__________(填序號字母)
A.容器內N2、H2、NH3的濃度之比為1:3:2
B.v(N2)正=3v(H2)逆 C.容器內壓強保持不變
D.混合氣體的密度保持不變 E.容器內混合氣體的平均分子量不變
③若改變某一條件,達新平衡時n(H2)=1.60mol ,下列說法正確的是_____________。
A.平衡一定正向移動 B.可能是向容器中加入了一定量的H2氣體
C.可能是降低了容器的溫度 D.可能是縮小了容器的體積
(2)450℃時,在另一密閉容器中進行上述合成氨的反應,各物質的起始濃度和平衡濃度如下表所示:
|
| N2 | H2 | NH3 |
| 起始濃度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡濃度(mol/L) | a | b | c |
請回答:
①各物質的平衡濃度可能是_______________.
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范圍是:_______________.
③請用數學表達式表示下列量之間的關系:
(I)a與b的關系:_______________。
(Ⅱ)a、b、c的關系:_______________。
(3) 根據最新“人工固氮”的研究報道,在常溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3的TiO2)表面與水可發生下列反應:2N2(g)+6H2O(l) 4NH3(g)+3O2(g),此反應的△S__________0(填“
”、 “
”或“=”), △H=_____________。
(已知:H2的燃燒熱為285.8 kJ/mol)
查看答案和解析>>
科目:高中化學 來源:2010-2011學年江西省協作體高三第二次聯考(理綜)化學部分 題型:填空題
已知:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,這是目前普遍使用的人工固氮的方法。請回答下列問題:
2NH3(g)△H=-92.4kJ/mol,這是目前普遍使用的人工固氮的方法。請回答下列問題:
(1)450℃時,往一個2L的密閉容器中充入2. 6mol H2和1mol N2, 反應過程中對NH3的濃度進行檢測,得到的數據如下表所示:
|
時間/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/mol·L—1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
①5 min內,消耗N2的平均反應速率為_______________,此條件下該反應的化學平衡常數K=_______________;反應達到平衡后,若往平衡體系中加入H2、N2和NH3各2mol,此時該反應的v(N2)正_______________v(N2)逆(填寫“>”、“=”或“<”=)。
②下列各項能作為判斷該反應達到化學平衡狀態的依據是__________(填序號字母)
A.容器內N2、H2、NH3的濃度之比為1:3:2
B.v(N2)正=3v(H2)逆 C.容器內壓強保持不變
D.混合氣體的密度保持不變 E.容器內混合氣體的平均分子量不變
③若改變某一條件,達新平衡時n(H2)=1.60mol ,下列說法正確的是_____________。
A.平衡一定正向移動 B.可能是向容器中加入了一定量的H2氣體
C.可能是降低了容器的溫度 D.可能是縮小了容器的體積
(2)450℃時,在另一密閉容器中進行上述合成氨的反應,各物質的起始濃度和平衡濃度如下表所示:
|
|
N2 |
H2 |
NH3 |
|
起始濃度(mol/L) |
0.2 |
0.3 |
0.2 |
|
平衡濃度(mol/L) |
a |
b |
c |
請回答:
①各物質的平衡濃度可能是_______________.
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范圍是:_______________.
③請用數學表達式表示下列量之間的關系:
(I)a與b的關系:_______________。
(Ⅱ)a、b、c的關系:_______________。
(3) 根據最新“人工固氮”的研究報道,在常溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3的TiO2)表面與水可發生下列反應:2N2(g)+6H2O(l)  4NH3(g)+3O2(g),此反應的△S__________0(填“
4NH3(g)+3O2(g),此反應的△S__________0(填“ ”、 “
”、 “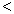 ”或“=”), △H=_____________。
”或“=”), △H=_____________。
(已知:H2的燃燒熱為285.8 kJ/mol)
查看答案和解析>>
科目:高中化學 來源:2009-2010學年安徽省安慶市潛山縣野寨中學高二(上)期中化學試卷(解析版) 題型:解答題
 3Z(g)△H<O
3Z(g)△H<O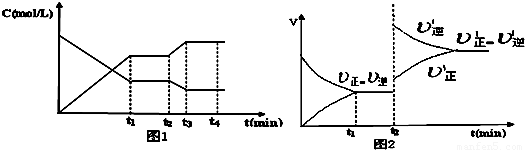
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com