
| 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
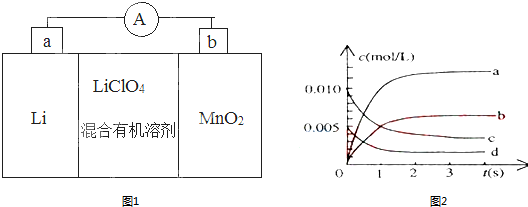
分析 (1)形成原電池反應時,Li為負極,被氧化,電極方程式為Li-e-=Li+,MnO2為正極,被還原,電極方程式為MnO2+e-+Li+=LiMnO2,結合電極方程式以及元素化合價的變化解答該題;
(1)①根據表格知,隨著反應的進行,一氧化氮的物質的量減小,則平衡向正反應方向移動,二氧化氮的物質的量逐漸增大,根據一氧化氮和二氧化氮之間轉化關系式計算平衡時二氧化氮的物質的量,從而確定曲線;
先計算一氧化氮的反應速率,再根據同一化學反應中同一時間段內,各物質的反應速率之比等于其計量數之比計算氧氣的反應速率;
②增大反應速率需增大反應物的濃度、升高溫度、使用催化劑等,增大反應物的濃度等可以使平衡向正反應方向移動.
解答 解:(1)①原電池工作時,Li為負極,MnO2為正極,電流從正極流向負極,所以外電路的電流方向是由b極流向a極,故答案為:b、a;
②MnO2為正極,被還原,電極方程式為MnO2+e-+Li+=LiMnO2,
故答案為:MnO2+e-+Li+=LiMnO2;
③因負極材料為Li,可與水反應,則不能用水代替電池中的混合有機溶劑,
故答案為:否;電極Li是活潑金屬,能與水反應;
(2)①根據表格知,隨著反應的進行,一氧化氮的物質的量減小,則平衡向正反應方向移動,二氧化氮的物質的量逐漸增大,當反應達到平衡狀態時,參加反應的n(NO)=(0.020-0.007)mol=0.013mol,根據二氧化氮和一氧化氮的關系式知,平衡狀態時生成n(NO2)等于參加反應的n(NO),所以為0.013mol,c(NO2)=$\frac{0.013mol}{2L}$=0.0065mol/L,所以代表二氧化氮的曲線為b;
0~2s時,v(NO)=$\frac{\frac{(0.020-0.008)mol}{2L}}{2s}$=0.003mol/(L.s),同一化學反應中同一時間段內,各物質的反應速率之比等于其計量數之比,所以v(O2)=$\frac{1}{2}$v(NO)=0.0015mol•L-1•S-1;
故答案為:b;0.0015mol•L-1•S-1;
②增大反應速率需增大反應物的濃度、升高溫度、使用催化劑等,增大反應物的濃度等可以使平衡向正反應方向移動,所以為使該反應的反應速率增大,且平衡向正反應方向移動,需要增大氧氣的濃度;
故答案為:c.
點評 本題考查電化學知識、反應速率的計算、化學平衡移動及其影響因素等,題目難度適中,能很好地考查學生的分析能力、計算能力以及電化學知識的綜合理解和運用,題目難度中等.


 開心蛙狀元測試卷系列答案
開心蛙狀元測試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | Al2O3→Al(OH)3 | B. | Na→Na2O2 | C. | Fe(OH)2→Fe(OH)3 | D. | Al(OH)3→AlO2- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 甲、乙、丙、丁 | B. | 丙、丁、乙、甲 | C. | 丙、丁、甲、乙 | D. | 丁、丙、乙、甲 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①⑤ | B. | ②③ | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
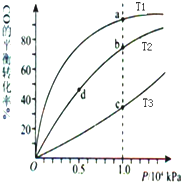
| A. | 溫度:T1>T2>T3 | B. | 平衡常數:K(a)>K(c) K(b)=K(d) | ||
| C. | 正反應速率:v(a)>v(c) v(b)>v(d) | D. | 平均摩爾質量:M(a)<M(c) M(b)>M(d) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X>Z>Y | B. | Z>Y>X | C. | X>Y>Z | D. | Z>X>Y |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應中共消耗1.75 mol H2SO4 | B. | 氣體甲中SO2與H2的體積比為1:4 | ||
| C. | 反應中共消耗65 g Zn | D. | 反應中共轉移3.6 mol電子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com