
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
分析 (1)根據反應的化學平衡常數等于生成物濃度冪之積與反應物濃度冪之積的比;
(2)某溫度下,平衡濃度符合下式:c2(SO3)=c(O2)•c2(SO2),先計算化學平衡常數,根據表中數據確定溫度;
(3)設該條件下O2的平衡轉化率為x,
O2(g)+2SO2(g)?2SO3(g),
開始(mol)0.30 0.60 0
反應(mol)0.30x 0.60x 0.60x
平衡(mol)0.30(1-x) 0.60(1-x) 0.60x
SO3的物質的量分數(SO3的物質的量與反應體系中總的物質的量之比)為$\frac{4}{7}$,根據三氧化硫物質的量分數計算x值;該根據平衡常數概念計算K;
(4)設O2與SO2混合氣體的物質的量分別為x、y,根據$\overline{M}$=$\frac{m總}{n總}$帶入計算x、y可得.
解答 解:(1)反應O2(g)+2SO2(g)?2SO3(g),K=$\frac{{c}^{2}(S{O}_{3})}{c({O}_{2})•{c}^{2}(S{O}_{2})}$;
故答案為:$\frac{{c}^{2}(S{O}_{3})}{c({O}_{2})•{c}^{2}(S{O}_{2})}$;
(2)根據c2(SO3)=c(O2)•c2(SO2),代入K=$\frac{{c}^{2}(S{O}_{3})}{c({O}_{2})•{c}^{2}(S{O}_{2})}$=1,平衡常數只與溫度有關,故此時溫度為830℃;
故答案為:830;
(3)設該條件下O2的平衡轉化率為x,
O2(g)+2SO2(g)?2SO3(g),
開始(mol)0.30 0.60 0
反應(mol)0.30x 0.60x 0.60x
平衡(mol)0.30(1-x) 0.60(1-x) 0.60x
SO3的物質的量分數為$\frac{4}{7}$,則$\frac{0.6x}{0.3(1-x)+0.6(1-x)+0.6x}$=$\frac{4}{7}$,解得x=$\frac{2}{3}$,設容器體積1L,K=$\frac{0.{4}^{2}}{0.{2}^{2}×0.1}$=40;
故答案為:$\frac{2}{3}$;40;
(4)設平均相對分子質量分別為57.6的混合氣體O2與SO2混合氣體的物質的量分別為x、y,則有$\frac{32x+64y}{x+y}$=56.7,解得$\frac{x}{y}$=$\frac{1}{4}$,混合氣體5L,則O2有1LSO2有4L,則O2在混合氣體中的體積分數為20%;同理設平均相對分子質量分別為44.8的混合氣體O2與SO2混合氣體的物質的量分別為a、b,有$\frac{32a+64b}{a+b}$=44.8,$\frac{a}{b}$=$\frac{3}{2}$,混合氣體5L,則O2有3LSO2有2L,則O2在混合氣體中的體積分數為60%;
故答案為:20%;60%.
點評 本題考查了化學平衡的有關計算,計算量大,學生要熟練掌握三段式解題的方法,并讀清題目信息靈活運用,題目難度較大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
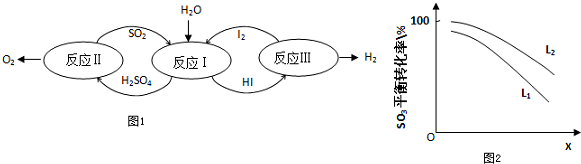
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
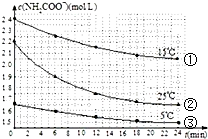 已知氨基甲酸銨發生的水解反應為:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,某研究小組得到c(NH2COO-)隨時間變化曲線如圖所示.下列有關說法一定正確的是( )
已知氨基甲酸銨發生的水解反應為:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,某研究小組得到c(NH2COO-)隨時間變化曲線如圖所示.下列有關說法一定正確的是( )| A. | 對比①與③,可知濃度越大水解速率越快 | |
| B. | 對比①與②,可知溫度越高水解速率越快 | |
| C. | 加水稀釋,平衡向正反應方向移動,K值增大 | |
| D. | 氨基甲酸銨在堿性條件下比在酸性條件下水解程度大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,W與R形成的化合物的化學式為Na3N.它們的晶體屬于離子晶體.
,W與R形成的化合物的化學式為Na3N.它們的晶體屬于離子晶體.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com