
【題目】已知25℃時有關弱酸的電離平衡常數見下表:
弱酸化學式 | HA | H2B |
電離平衡常數/ mol/ L | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
則下列說法正確的是
A. 等物質的量濃度的各溶液pH關系為:pH(Na2B)>pH(NaHB)>pH(NaA)
B. 將等濃度的 HA溶液與NaA溶液等體積混合,混合液中:c(A-)<c(Na+)
C. 向 Na2B溶液中加入足量的 HA溶液發生反應的離子方程式為:B2-+2HA=2A-+H2B
D. NaHB溶液中部分微粒濃度的關系為:c(Na+)=c(HB-) +c(H2B)+c(B2-)
【答案】D
【解析】
電離常數越大,酸性越強,由表中數據可知酸性,酸性H2B>HA>HB-,化學反應應滿足以強制弱的特點,HA的電離常數為1.7×10-6,則A-的水解常數為![]() ,據此解答。
,據此解答。
A.酸性H2B>HA>HB-,酸性越強,對應的鈉鹽的堿性越弱,A錯誤;
B.HA的電離常數為1.7×10-6,則A-的水解常數為![]() ,可知HA的電離常數大于A-的水解常數,若等濃度的 HA溶液與NaA溶液等體積混合溶液呈酸性,HA電離作用大于A-水解作用,所以c(A-)>c(Na+),B錯誤;
,可知HA的電離常數大于A-的水解常數,若等濃度的 HA溶液與NaA溶液等體積混合溶液呈酸性,HA電離作用大于A-水解作用,所以c(A-)>c(Na+),B錯誤;
C.酸性H2B>HA>HB-,向Na2B溶液中加入足量的HA溶液發生反應的離子方程式為:B2-+HA=A-+HB-,C錯誤;
D.根據物料守恒可得NaHB溶液中部分微粒濃度的關系為c(Na+)=c(HB-) +c(H2B)+c(B2-),故D正確。


 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案科目:高中化學 來源: 題型:
【題目】(1)某溫度下,向2m g 16%的CuSO4溶液中加入m g CuSO45H2O,溶液恰好達到飽和,該飽和溶液中CuSO4的質量分數為_____。
(2)標準狀況下,1體積水可溶解V體積HCl氣體,所得溶液的密度為ρg/cm3,則所得溶液溶質的質量分數表示為_____,溶質的物質的量濃度表示為_____。
(3)若以ω1和ω2分別表示濃度為a molL﹣1和b molL﹣1硫酸溶液的溶質的質量分數,且知 2a=b,則下列推斷正確的是(硫酸溶液的密度比純水的大)_____(填序號)
A. 2ω1=ω2 B. ω2<2ω1 C. ω2>2ω1 D. ω1<ω2<2ω1
(4)若以ω1和ω2分別表示濃度為a molL﹣1和b molL﹣1氨水的溶質的質量分數,且知2ω1=ω2,則下列推斷正確的是(氨水的密度比純水的小)_____(填序號)
A. 2a=b B. 2a<b C. 2a>b D. a<b<2a.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知在稀溶液里,強酸跟強堿發生中和反應生成1 mol液態水時反應熱叫做中和熱。現利用下圖裝置進行中和熱的測定,請回答下列問題:

(1)圖中未畫出的實驗器材是________________、________________。
(2)做一次完整的中和熱測定實驗,溫度計需使用________次。
(3)實驗時,將0.50 mol·L-1的鹽酸加入到0.55mol·L-1的NaOH溶液中,兩種溶液的體積均為50 mL,各溶液的密度均為1 g /cm3,生成溶液的比熱容c=4.18 J /(g· oC),實驗的起始溫度為t1 oC,終止溫度為t2 oC。測得溫度變化數據如下:
序號 | 反應物 | 起始溫度t1/ oC | 終止溫度t2/ oC | 中和熱 |
① | HCl+NaOH | 14.8 | 18.3 | ΔH1 |
② | HCl+NaOH | 15.1 | 19.7 | ΔH1 |
③ | HCl+NaOH | 15.2 | 18.5 | ΔH1 |
④ | HCl+NH3·H2O | 15.0 | 18.1 | ΔH2 |
①試計算上述兩組實驗測出的中和熱ΔH1=______________。
②某小組同學為探究強酸與弱堿的稀溶液反應時的能量變化,又多做了一組實驗④,用0.55mol·L-1的稀氨水代替NaOH溶液,測得溫度的變化如表中所列,試計算反應的ΔH2=____________。
③兩組實驗結果差異的原因是___________________________________________。
④寫出HCl+NH3· H2O反應的熱化學方程式:_______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】紅礬鈉(Na2Cr2O7·2H2O)是重要的化工原料,工業上用鉻鐵礦(主要成分是FeO·Cr2O3)制備紅礬鈉的過程中會發生如下反應:
4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g) ![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)如圖為上述反應的濃度—時間圖像,由圖像判斷反應進行至t2時刻時,改變的條件是_________________________,如圖為上述反應的速率—時間圖像,表示上述反應在t1時達到平衡, 在t2時因改變某個條件而使曲線發生變化。由圖判斷,t2時刻曲線變化的原因可能是________(填寫序號)。
a.升高溫度 b.加催化劑
c.通入O2 d.縮小容器體積

(2)工業上可利用上述反應的副產物CO2來生產甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①一定溫度下,在容積為1L的密閉容器中,充入2 mol CO2和4 mol H2,一段時間后達到平衡,測得CH3OH的物質的量濃度為1mol/L,則該溫度下此反應的平衡常數為_________,某時刻測得CO2、H2、CH3OH和H2O的物質的量分別為2mol,1mol,1mol,1mol,則這一時刻v(正)___________v(逆)
②在T1溫度時,將1 mol CO2和3 mol H2充入一密閉容器中,充分反應達到平衡后,CO2轉化率為α,則容器內的壓強與起始壓強之比為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,水的電離可達到平衡:H2O![]() H++OH- ΔH>0。下列敘述正確的是
H++OH- ΔH>0。下列敘述正確的是
A. 向水中加入稀氨水,平衡逆向移動,c(OH-)降低
B. 將水加熱,Kw增大,pH不變
C. 向水中加入少量CH3COONa固體,平衡逆向移動,c (H+)降低
D. 向水中加入少量固體硫酸氫鈉,c(H+)增大,Kw不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某新型水系鈉離子電池工作原理如下圖所示。TiO2光電極能使電池在太陽光照下充電,充電時 Na2S4轉化為 Na2S。下列說法正確的是
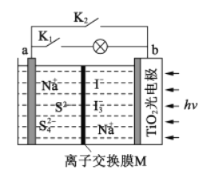
A. 充電時,太陽能轉化為化學能,化學能又轉化為電能
B. 放電時,a極為正極
C. 充電時,陽極的電極反應式為3I--2e-=I3-
D. M可以使用陰離子交換膜
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從海水(主要是水和氯化鈉,還有少量的鎂離子等)中提取鎂,可按如下步驟進行:
①把貝殼(主要成分碳酸鈣)制成石灰乳(氫氧化鈣的懸濁液);
②在引入的海水中加入石灰乳,沉降、過濾、洗滌沉淀物(主要是氫氧化鎂);
③將沉淀物與鹽酸反應,結晶過濾、在HCl氣體氛圍中干燥產物,得到氯化鎂產物;
④將得到的產物熔融電解得到鎂。
下列說法不正確的是
A. 向海水中加入硝酸銀會產生白色沉淀
B. 步驟②中涉及到的離子反應方程式為2OH-+Mg2+=Mg(OH)2↓
C. ①②③步驟涉及化合、分解和復分解反應
D. 第④步的反應屬于分解反應也是氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在1 L恒容密閉容器中加入1 mol的N2(g)和3 mol H2(g)發生反應:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,NH3的物質的量與時間的關系如表所示,下列說法錯誤的是( )
2NH3(g) ΔH<0,NH3的物質的量與時間的關系如表所示,下列說法錯誤的是( )
時間/min | 0 | t1 | t2 | t3 |
NH3物質的量/mol | 0 | 0.2 | 0.3 | 0.3 |
A. 0~t1 min,v(NH3)=0.2/t1 mol·L-1·min-1
B. 升高溫度,可使正反應速率減小,逆反應速率增大,故平衡逆向移動
C. N2(g)+3H2(g)![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g)![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. t3 min時再加入1 mol的N2(g)和3 mol H2(g),反應達到新平衡時,c(N2)>0.85 mol·L-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com