
【題目】二甲醚又稱甲醚,簡稱DME,熔點-141.5℃,沸點-24.9℃,與石油液化氣(LPG) 相似,被譽為“21世紀的清潔燃料”。制備原理如下:
I.由天然氣催化制備二甲醚:
①2CH4(g)+O2(g)![]() CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
II.由合成氣制備二甲醚:
②CO(g) +2H2(g)![]() CH3OH(g) △H2=- 90.7 kJ/mol
CH3OH(g) △H2=- 90.7 kJ/mol
③2CH3OH (g)![]() CH3OCH3(g) +H2O(g) △H3
CH3OCH3(g) +H2O(g) △H3
回答下列問題:
(1) 反應③中的相關的化學鍵鍵能數據如表:
化學鍵 | H—H | C—O | H—O(水) | H—O(醇) | C—H |
E/(kJ/mol ) | 436 | 343 | 465 | 453 | 413 |
△H3=_______kJ/mol。
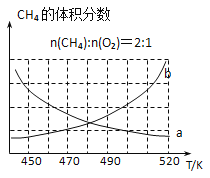
(2) 制備原理I中,在恒溫、恒容的密閉容器中合成,將氣體按n(CH4): n(O2) =2: 1混合,能正確反映反應①中CH4的體積分數隨溫度變化的曲線是_______。下列能表明反應①達到化學平衡狀態的是________。
a.混合氣體的密度不變
b.反應容器中二甲醚的百分含量不變
c.反應物的反應速率與生成物的反應速率之比等于化學計量數之比
d.混合氣體的壓強不變
(3) 有人模擬制備原理II,在500K時的2L 的密閉容器中充入2mol CO和6mol H2,8min達到平衡,平衡時CO 的轉化率為80%,c(CH3OCH3)=0.3mol/L,用H2表示反應②的速率是______;可逆反應③的平衡常數K=_______。若在500K 時,測得容器中n(CH3OH)=n(CH3OCH3),此時反應③v ( 正)______v (逆),說明原因________________。
【答案】 -24kJ/mol b bd 0.2mol/(L·min) 2.25 > 濃度商Q<2.25,反應正向進行,V(正)>v(逆)
【解析】(1)反應③2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3=反應物總鍵能-生成物總鍵能=
CH3OCH3(g)+H2O(g) △H3=反應物總鍵能-生成物總鍵能=![]() =-24kJ/mol;(2)升溫,反應①2CH4(g)+O2(g)
=-24kJ/mol;(2)升溫,反應①2CH4(g)+O2(g) ![]() CH3OCH3(g)+H2O(g) △H1=﹣283.6kJ/mol,向逆反應方向移動,能正確反映反應①中CH4的體積分數隨溫度變化的曲線是b;表明反應①2CH4(g)+O2(g)
CH3OCH3(g)+H2O(g) △H1=﹣283.6kJ/mol,向逆反應方向移動,能正確反映反應①中CH4的體積分數隨溫度變化的曲線是b;表明反應①2CH4(g)+O2(g) ![]() CH3OCH3(g)+H2O(g)達到化學平衡狀態的a.混合氣體的密度始終不變,故a錯誤;b.反應容器中二甲醚的百分含量不變,表明達到平衡,故b正確;c.反應物的反應速率與生成物的反應速率之比始終等于化學計量數之比;故c錯誤;d.混合氣體的壓強不變,表明達到平衡,故d正確。答案選bd;
CH3OCH3(g)+H2O(g)達到化學平衡狀態的a.混合氣體的密度始終不變,故a錯誤;b.反應容器中二甲醚的百分含量不變,表明達到平衡,故b正確;c.反應物的反應速率與生成物的反應速率之比始終等于化學計量數之比;故c錯誤;d.混合氣體的壓強不變,表明達到平衡,故d正確。答案選bd;
(3) CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始量(mol/L) 1 3 0
轉化量(mol/L) 0.8 1.6 0.8
平衡量(mol/L) 0.2 1.4 0.8
v(H2)= ![]() =0.2mol/(Lmin);
=0.2mol/(Lmin);
2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
起始量(mol/L) 0.8 0 0
轉化量(mol/L) 0.6 0.3 0.3
平衡量(mol/L) 0.2 0.3 0.3
k= ![]() = 2.25;
= 2.25;
若在500K時,容器中n(CH3OH)=n(CH3OCH3)時,設c(CH3OH)=x mol/L,則
2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
在500K時,容器中(mol/L) x x x
濃度商Q=![]() =1<2.25,反應正向進行,v(正)>v(逆)。
=1<2.25,反應正向進行,v(正)>v(逆)。


科目:高中化學 來源: 題型:
【題目】X、Y、Z、W是元素周期表中前36號元素,且原子序數依次增大。其相關信息如下表:
元素編號 | 元素性質或原子結構 |
X | X原子的最外層電子數是其內層電子總數的2倍 |
Y | Y的基態原子價電子排布式為nsnnpn+2 |
Z | 最外層中只有兩對成對電子 |
W | 前四周期基態原子中,W元素的未成對電子數最多 |
(1)元素X最高價氧化物分子的空間構型是__________________,是_________(填“極性”或“非極性”)分子。
(2)Y的最簡單氫化物的沸點比Z的最簡單氫化物的沸點高,原因是____________________________________
(3)基態Z原子中,電子占據的最高電子層符號為_________,該電子層具有的原子軌道數為________________
(4)元素W位于元素周期表的第________族。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨及其相關工業中,部分物質間的轉化關系如下:

下列說法不正確的是( )
A. 反應Ⅰ、Ⅱ、Ⅲ、Ⅳ均屬于氧化還原反應
B. 上述轉化中包含了氨氣、硝酸、硝銨、小蘇打、純堿的工業生產方法
C. 反應Ⅳ和Ⅵ中的部分產物可在上述流程中循環利用
D. 反應V是先向飽和氯化鈉溶液中通CO2至飽和再通NH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黃銅灰渣(含有Cu、Zn、CuO、ZnO 及少量的FeO、Fe2O3) 生產氯化銅晶體的流程如下:
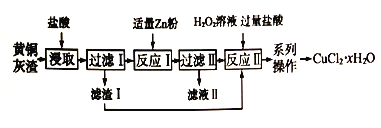
(1)反應I中所加Zn 粉不能過量的原因是_____________。
(2)濾液I中含有的主要金屬陽離子是_____________。
(3) 寫出反應II 的化學方程式_____________。
(4)“系列操作”包括蒸發濃縮、冷卻結晶、過濾、______、_____。
(5) 在空氣中直接加熱CuCl2·xH2O晶體得不到純的無水CuCl2,原因是_____________。
(6) 298K 時,向c (Cu2+) =0.02mol/L的溶液中加入氫氧化鈉來調節溶液的pH,若反應后溶液pH=10,此時Cu2+是否沉淀完全? _____{列式計算,己知:Ksp[Cu(OH)2] =2.2×10-20,c(Cu2+)<1×10-5mol/L 視為沉淀完全}_____。
(7) CuCl2·xH2O晶體中x值的測定:稱取3.420 g 產品溶解于適量水中,向其中加入含AgNO34.400×10-2mol 的AgNO3溶液(溶液中除Cl- 外,不含其他與Ag+反應的離子),待C1-完全沉淀后,用含Fe3+的溶液作指示劑,用0.2000 mol/L 的KSCN 標準溶液滴定剩余的AgNO3。使剩余的Ag+以AgSCN 白色沉淀的形式析出。
①滴定終點的現象是__________。
②若滴定過程用去上述濃度的KSCN 標準溶液20.00mL,則CuCl2·xH2O中x值為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學-選修5:有機化學基礎]
親水型功能高分子M和香料N可由如圖所示途徑合成(部分產物略去):

已知:
①A是芳香烴的含氧衍生物,相對分子質量為108
②有機物分子中,同一個碳原子上連接有兩個羥基時不穩定,會自動脫水
(S)R1CHO + R2CH2CHO![]() R1CH=
R1CH=![]() +H2O
+H2O
請回答下列問題:
(1)E的化學名稱_______,C的結構簡式 _______;
(2) M中的含氧官能團的名稱為_______,A生成B的反應類型________;
(3)寫出F到G的第一步化學方程式______________;
(4)同時滿足下列條件的G的同分異構體有____種(不考慮立體異構,不計G本身)
①苯環上有四種不同的氫
②能與NaHCO3溶液反應產生氣體
③遇氯化鐵溶液會顯色
④分子中只存在一個環
(5)仿照題中的合成線路圖,以乙醇為起始物,無機試劑任選,寫出合成聚-2-丁烯醛的線路圖:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 環己烷與苯可用酸性KMnO4溶液鑒別
B. 淀粉和纖維素互為同分異構體
C. 植物油氫化過程中發生了加成反應
D. 水可以用來分離溴苯和苯的混合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含鈷化合物在機械制造、磁性材料等領域具有廣泛的應用,請回答下列問題:
(1)基態Co3+的價電子排布圖為____。
(2)鈷的配合物[Co(NH3)5Br](NO3)2
①第一電離能N_____O(填“大于”、“小于”或“不能確定”);兩種配位原子的雜化軌道類型均為____;
②鈷離子周圍配位鍵數目(配位數)是 ___;N03-的空間構型為____;
③已知Br的含氧酸酸性由強到弱的順序為HBrO4>HBrO3>HBrO2>HBrO,其原因是____。
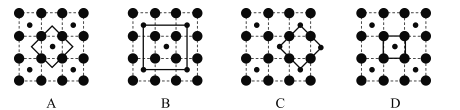
(3)某鈷氧化物品體具有CoO2的層狀結構如下圖所示(小球表示Co,大球表示O)。下列用粗線面出的結構單元不能描述CoO2)的化學組成的是_____
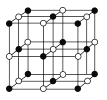
(4)Co的另一種氧化物的晶胞如圖,已知鈷原子的半徑為apm,氧原子的半徑為b pm,它們在晶體中是緊密接觸的,鈷原子填在氧原子的 ___填“正八面體”、“正四面體”或“立方體”)空隙;鈷原子與跟它次近鄰的氧原子之間的距離為____;在該鈷的氧化物品體中原子的空間利用率為____(均用含a、b的計算表達式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化反應與還原反應在同一元素中進行的是( )
A. Cl2+2NaOH=NaCl+NaClO+H2O
B. Fe+CuSO4=FeSO4+Cu
C. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D. 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com