
【題目】氫氣是一種清潔能源。可由CO和水蒸氣反應制備,其能量變化如下圖所示。

(1)該反應為可逆反應。在800 ℃時,若CO的起始濃度為2.0 mol·L-1,水蒸氣的起始濃度為3.0 mol·L-1,達到化學平衡狀態后,測得CO2的濃度為1.2 mol·L-1,則此反應的平衡常數為___,隨著溫度升高該反應的化學平衡常數的變化趨勢是___。(填“變大”、“變小”或“不變”)
(2)某溫度下,該反應的平衡常數為K=1/9。該溫度下在甲、乙、丙三個恒容密閉容器中投入H2O(g)和CO(g),其起始濃度如下表所示。下列判斷不正確的是____(填字母)。
起始濃度 | 甲 | 乙 | 丙 |
c(H2O)/mol·L-1 | 0.010 | 0.020 | 0.020 |
c(CO)/mol·L-1 | 0.010 | 0.010 | 0.020 |
A. 反應開始時,丙中的反應速率最快,甲中的反應速率最慢
B. 平衡時,甲中和丙中H2O的轉化率均是25%
C. 平衡時,丙中c(CO2)是甲中的2倍,是0.015 mol·L-1
D. 平衡時,乙中H2O的轉化率大于25%
(3)一定條件下,可逆反應N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,達到平衡后:
2NH3(g) ΔH<0,達到平衡后:
①加催化劑,v(正)、v(逆)都發生變化,且變化的倍數__(填“相等”或“不相等”)。
②縮小體積使體系壓強增大,則v(正)___,v(逆)___(填“增大”、“減小”或“不變”),v(正)變化的倍數__v(逆)變化的倍數(填“大于”、“小于”或“等于”)。
③降溫,v(正) ____,v(逆)__(填“增大”、“減小”或“不變”)。
④溫恒壓,再通入一定量的He,達到新平衡時,N2的轉化率__,c(H2)將__(填“增大”、“減小”或“不變”)。
【答案】1 變小 CD 相等 增大 增大 大于 減小 減小 減小 減小
【解析】
(1)利用三段式列式計算;根據圖中能量的轉化關系判斷反應是放熱反應,再結合化學平衡常數與溫度的關系作答;
(2)A. 根據濃度對化學反應速率的影響作答;
B. 設甲中轉化的H2O(g)的濃度為xmol·L-1進行求解;再結合等效平衡思想分析丙中的轉化率;
C. 結合轉化率求出丙中的平衡濃度;
D. 利用等效平衡思想分析作答;
(3)根據外界因素對化學反應速率與化學平衡的綜合影響分析作答。
(1) CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始濃度(mol·L-1) 2.0 3.0 0 0
轉化濃度(mol·L-1) 1.2 1.2 1.2 1.2
平衡濃度(mol·L-1) 0.8 1.8 1.2 1.2
故平衡常數K=![]() =1;
=1;
根據能量變化關系圖可知該反應為放熱反應,溫度升高,平衡向逆反應方向移動,平衡常數減小。
(2)A. 反應物濃度越大,反應速率越大,故開始時反應速率大小:甲<乙<丙,A項正確;
B. 設甲中轉化的H2O(g)的濃度為xmol·L-1,則K=![]() ,故x=0.0025,即轉化率為25%,丙中加入的CO(g)和H2O(g)的比與甲中相同,故轉化率相同,B項正確;
,故x=0.0025,即轉化率為25%,丙中加入的CO(g)和H2O(g)的比與甲中相同,故轉化率相同,B項正確;
C. 平衡時,丙中c(CO2)是甲中的2倍,由于轉化率為25%,故丙中c(CO2)=0.02 mol·L-1×25%=0.005 mol·L-1,C項錯誤;
D. 若乙中c(H2O)=0.01 mol·L-1,平衡時H2O的轉化率等于25%,但乙中c(H2O)=0.02 mol·L-1,故其轉化率小于25%,D項錯誤;
故答案選CD;
(3)可逆反應N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,
2NH3(g) ΔH<0,
①加催化劑,v(正)、v(逆)會同等程度增大,故答案為:相等。
②縮小體積使體系壓強增大,v(正)與v(逆)均增大,v(正)變化的倍數大于v(逆)變化的倍數,使平衡向正反應方向移動,知道最終v(正)與v(逆)相等,達到新的平衡狀態,故答案為:增大;增大;大于;
③降溫,化學反應速率減小,則v(正)與v(逆)均減小,故答案為:減小;減小;
④恒溫恒壓,再通入一定量的He,相當于增大反應氣體的體積,反應物的濃度減小,等效于恒容條件下減小壓強,則平衡會向逆反應方向移動,故達到新平衡時,N2的轉化率減小,因體積增大導致c(H2)也將減小,故答案為:減小;減小。


 互動英語系列答案
互動英語系列答案 名牌學校分層周周測系列答案
名牌學校分層周周測系列答案科目:高中化學 來源: 題型:
【題目】某興趣小組設計了如圖所示的實驗裝置,既可用于制取氣體,又可用于驗證物質的性質。
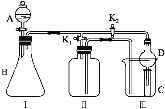
(1)打開K1關閉K2,可制取某些氣體。甲同學認為裝置Ⅰ可用于制取H2、NH3、O2,但裝置Ⅱ只能收集H2、NH3,不能收集O2。其理由是_____。乙同學認為在不改動裝置Ⅱ儀器的前提下,對裝置Ⅱ進行適當改進,也可收集O2。你認為他的改進方法是_____。
(2)打開K2關閉K1,能比較一些物質的性質。丙同學設計實驗比較氧化性:KClO3>Cl2>Br2。在A中加濃鹽酸后一段時間,觀察到C中的現象是______;儀器D在該裝置中的作用是_______。在B裝置中發生反應的離子方程式為______。丁同學用石灰石、醋酸、苯酚鈉等藥品設計了另一實驗。他的實驗目的是_____。
(3)實驗室常用濃H2SO4與硝酸鈉反應制取HNO3。下列裝置中最適合制取HNO3的是_____。實驗室里貯存濃硝酸的方法是_______。
a 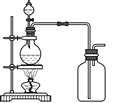 b
b 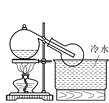 c
c 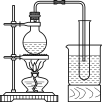 d
d 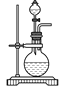
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2L的密閉容器中,發生以下反應:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒鐘A的平均反應速度為0.12 mol/(L·s),則10秒鐘時,容器中B的物質的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒鐘A的平均反應速度為0.12 mol/(L·s),則10秒鐘時,容器中B的物質的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上制取冰晶石(Na3AlF6)的化學方程式如下:![]()
完成下列填空:
(1)反應中四種元素對應的簡單離子核外電子排布相同,請按離子半徑從大到小的順序排列這四種離子____,其中原子序數最大的元素原子核外有___種能量不同的電子,其最外層電子的電子云有____種不同的伸展方向。
(2)反應中有兩種元素在元素周期表中位置相鄰,能比較它們的金屬性或非金屬性強弱的事實是____(選填編號)。
a. 氣態氫化物的穩定性 b. 最高價氧化物對應水化物的酸性
c. 單質與氫氣反應的難易 d. 單質與同濃度酸發生反應的快慢
反應中兩種金屬元素,它們的最高價氧化物對應的水化物之間發生反應的離子方程式為_______。
(3)冰晶石在工業上可做電解氧化鋁的助溶劑,此反應中若有0.6mol電子轉移,則在____極可得金屬鋁的質量為_____克。
(4)工業上不采用電解氯化鋁的方法而是采用電解氧化鋁的方法獲得鋁單質的原因是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在1.0 L恒容密閉容器中投入1 mol CO2和2.75 mol H2發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),實驗測得不同溫度及壓強下,平衡時甲醇的物質的量變化如圖所示。下列說法正確的是
CH3OH(g)+H2O(g),實驗測得不同溫度及壓強下,平衡時甲醇的物質的量變化如圖所示。下列說法正確的是
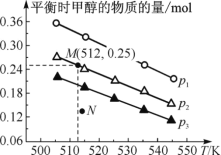
A. 該反應的正反應為放熱反應
B. 壓強大小關系:p1<p2<p3
C. M點對應的平衡常數K的值約為 1.04×10-2
D. 在p2及512 K時,圖中N點v(正)<v(逆)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關純堿和小蘇打的敘述中正確的是 ( )
A. Na2CO3和NaHCO3都既能與酸反應,又能與氫氧化鈉溶液反應
B. 等質量Na2CO3、NaHCO3分別與相同濃度鹽酸反應,NaHCO3消耗的鹽酸體積少
C. 向NaHCO3溶液中滴入Ba(OH)2溶液無沉淀,而Na2CO3溶液中加入Ba(OH)2溶
液出現白色沉淀
D. 等物質的量Na2CO3、NaHCO3分別與足量稀H2SO4反應,NaHCO3產生CO2多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校化學興趣小組的同學用滴定法對一含有少量Na2SO4的NaOH樣品中NaOH的含量進行測定。回答下列問題:
(1)用分析天平準確稱取該樣品5.0 g,全部溶于水配制成1 000.0 mL的溶液。用____(填儀器名稱)量取20.00 mL放在錐形瓶中,滴加幾滴酚酞,待測。該中和滴定中滴定終點的現象是___。
(2)用0.10 mol·L-1稀鹽酸滴定未知濃度的NaOH溶液,實驗數據如下表所示:
實驗編號 | 待測NaOH溶液的體積/mL | 稀鹽酸的體積/mL |
1 | 20.00 | 24.01 |
2 | 20.00 | 23.99 |
3 | 20.00 | 22.10 |
計算樣品中NaOH的質量分數為______。
(3)若滴定前,滴定管尖端有氣泡,滴定終了氣泡消失,將使所測結果____ (填“偏高”、“偏低”或“不變”,下同);若滴定過程中不慎將錐形瓶中溶液灑出,會使所測結果_____;若讀酸式滴定管讀數時,滴定前仰視讀數,滴定后正確讀數,則所測結果____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據熱化學方程式N2(g)+3H2(g)2NH3(g)+92kJ,下列有關圖象和敘述中正確的是
A.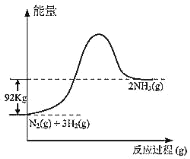
B.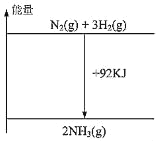
C.向密閉容器中通入1mol氮氣和3mol氫氣發生反應放出92kJ的熱量
D.形成1mol氮氮鍵和3mol氫氫鍵所放出的能量比拆開2mol氮氫鍵所吸收的能量多92kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是25℃時五種物質的溶度積常數,下列有關說法錯誤的是
化學式 |
|
| CuS |
|
|
溶度積 |
|
|
|
|
|
A.根據表中數據可推知,常溫下![]() 在純水中的溶解度比
在純水中的溶解度比![]() 的大
的大
B.向![]() 溶液中通入
溶液中通入![]() 可生成CuS沉淀,是因為
可生成CuS沉淀,是因為![]()
C.根據表中數據可推知,向硫酸鋇沉淀中加入飽和碳酸鈉溶液,不可能有碳酸鋇生成
D.常溫下,![]() 在
在![]() 溶液中比在
溶液中比在![]() 溶液中的溶解度小
溶液中的溶解度小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com