
【題目】為了實現“將全球溫度上升幅度控制在2℃以內”的目標,科學家正在研究溫室氣體CO2的轉化和利用。
(1)海洋是地球上碳元素的最大“吸收池”
①溶于海水中的CO2主要以四種無機碳形式存在,分別為CO2、H2CO3、CO32-和_________(填離子符號)。
②在海洋中,可通過如圖所示的途徑來固碳。則發生光合作用時,CO2與H2O反應生成(CH2O)x和O2的化學方程式為__________________。

(2)有科學家提出可利用FeO來吸收CO2,已知:
C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
CO2(g)+2H2(g) △H=+113.4 kJ·mol-1
3FeO(s)+H2O(g)![]() Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
Fe3O4(s)+H2(g) △H=+18.7 kJ·mol-1
則6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s) △H=_____kJ·mol-1。
2Fe3O4(s)+C(s) △H=_____kJ·mol-1。
(3)以CO2為原料可制備甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),向一恒容密閉容器中充入1moCO2(g)和3molH2(g),測得CO2(g)和CH3OH(g)的濃度隨時間的變化如圖所示。
CH3OH(g)+H2O(g),向一恒容密閉容器中充入1moCO2(g)和3molH2(g),測得CO2(g)和CH3OH(g)的濃度隨時間的變化如圖所示。
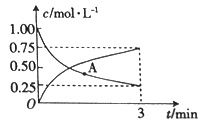
①若A點的正反應速率用v正(CO2)來表示,A點的逆反應速率用v逆(CO2)來表示,則v正(CO2)_______(填“>”“ <”或“=”)v逆(CO2)。
②0~3min內,氫氣的平均反應速率v(H2)_______________。
(4)在一定條件下,二氧化碳轉化為甲烷:CO2(g)+4H2(g)![]() CH4(g)+2 H2O(g),△H。向一密閉容積正充入一定量的CO2和H2,在300℃時發生上述反應,達到平衡時測得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。則該溫度下上述反應的平衡常數K= ________。若200℃時該反應的平衡常數K=64.8,則該反應的△H_____(填“>’’或“<”)O。
CH4(g)+2 H2O(g),△H。向一密閉容積正充入一定量的CO2和H2,在300℃時發生上述反應,達到平衡時測得c(CO2)= 0.2 mol·L-1,c(H2) =0.8 mol·L-1,c(H2O)=1.6mol·L-1。則該溫度下上述反應的平衡常數K= ________。若200℃時該反應的平衡常數K=64.8,則該反應的△H_____(填“>’’或“<”)O。
【答案】 HCO3- ![]() -76.0 > 0.75mol·L-1·min-1 25 <
-76.0 > 0.75mol·L-1·min-1 25 <
【解析】(1)①溶于海水中的CO2主要以四種無機碳形式存在,分別為CO2、H2CO3、CO32-和HCO3-;②發生光合作用時,CO2與H2O在葉綠素和酶的作用下反應生成(CH2O)x和O2,其反應的化學方程式為:![]() ;(2)已知:①C(s)+2H2O(g)
;(2)已知:①C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H1=+113.4 kJ·mol-1 ,
CO2(g)+2H2(g) △H1=+113.4 kJ·mol-1 ,
②3FeO(s)+H2O(g)![]() Fe3O4(s)+H2(g) △H2=+18.7 kJ·mol-1,根據蓋斯定律,由②×2-①可得反應:6FeO(s)+CO2(g)
Fe3O4(s)+H2(g) △H2=+18.7 kJ·mol-1,根據蓋斯定律,由②×2-①可得反應:6FeO(s)+CO2(g)![]() 2Fe3O4(s)+C(s) △H=2△H2-△H1=+18.7 kJ·mol-1×2-113.4 kJ·mol-1 = -76.0kJ·mol-1;(3) ①根據圖中信息可知,CO2(g)的濃度還在降低,CH3OH(g)的濃度還在增大,反應還在向正方向進行且沒達到平衡狀態,則v正(CO2) >v逆(CO2);②0~3min內,CO2的平均反應速率v(CO2)=
2Fe3O4(s)+C(s) △H=2△H2-△H1=+18.7 kJ·mol-1×2-113.4 kJ·mol-1 = -76.0kJ·mol-1;(3) ①根據圖中信息可知,CO2(g)的濃度還在降低,CH3OH(g)的濃度還在增大,反應還在向正方向進行且沒達到平衡狀態,則v正(CO2) >v逆(CO2);②0~3min內,CO2的平均反應速率v(CO2)=![]() ,化學反應速率之比等于計量數之比,則氫氣的平均反應速率v(H2)=3 v(CO2)=
,化學反應速率之比等于計量數之比,則氫氣的平均反應速率v(H2)=3 v(CO2)=![]() ×3=0.75mol·L-1·min-1;(4)c(CH4)=
×3=0.75mol·L-1·min-1;(4)c(CH4)=![]() c(H2O)=
c(H2O)=![]() ×1.6mol·L-1=0.8 mol·L-1,根據反應CO2(g)+4H2(g)
×1.6mol·L-1=0.8 mol·L-1,根據反應CO2(g)+4H2(g)![]() CH4(g)+2 H2O(g)可得300℃時,平衡常數K=
CH4(g)+2 H2O(g)可得300℃時,平衡常數K=![]() =
=![]() =25;若200℃時該反應的平衡常數K=64.8>25,則升高溫度,平衡常數減小,則平衡向逆反應方向移動,逆反應方向為吸熱反應,正反應方向為放熱反應,△H<0。
=25;若200℃時該反應的平衡常數K=64.8>25,則升高溫度,平衡常數減小,則平衡向逆反應方向移動,逆反應方向為吸熱反應,正反應方向為放熱反應,△H<0。


 導學教程高中新課標系列答案
導學教程高中新課標系列答案 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:
【題目】常溫下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4種,且溶液中各離子的物質的量濃度均為0.1mol/L,現取該溶液進行有關實驗,實驗結果如下圖所示。下列有關說法正確的是

A. 實驗消耗Cu 14.4g,則生成氣體丁的體積為3.36L
B. 該溶液中一定有上述離子中的NO3-、Al3+、SO42-、Cl-四種離子
C. 沉淀乙一定有BaCO3,可能有BaSO4
D. 一定沒有Fe3+,但是無法確定是否含有I-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】材料的不斷發展促進社會的進步。
(1)“天宮二號”內大量使用了碳纖維復合材料,在碳纖維復合材料中,碳纖維屬于_____(填“增強劑”或“基體”);聚乙烯塑料常用于食品包裝,聚乙烯塑料屬于_________(填“熱固性”或“熱塑性”)塑料。硫化橡膠具有較高的強度和化學穩定性,它具有___________結構。天然橡膠的結構簡式是________(填字母)。
 c. (C6H10O5)n
c. (C6H10O5)n
鋼鐵生銹的負極電極反應式為:_________________________。
(2)2015年某研究機構用一種新材料鎳納米粒子作催化劑,將二氧化碳和氫氣在加熱條件下轉化為甲烷,該反應的化學方程式為________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出下列反應的化學方程式:
(1)實驗室制取乙炔___________________。
(2)2 -氯丙烷的消去反應___________________。
(3)用甲苯制TNT的反應___________________。
(4)l,2-二氯乙烷與NaOH溶液共熱___________________。
(5)![]() 中含有的含氧官能團名稱________。
中含有的含氧官能團名稱________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電爐加熱時用純O2氧化管內樣品,根據產物的質量確定有機物的組成。下列裝置是用燃燒法確定有機物分子式常用的裝置

(1)A裝置中MnO2的作用是________________;
(2)B裝置中濃硫酸的作用是________________;
(3)燃燒管中CuO的作用是___________________;
(4)若實驗中所取樣品只含C、H、O三種元素中的兩種或三種,準確稱取1.38 g樣品,經充分反應后,D管質量增加1.62g,E管質量增加2.64g,則該樣品的實驗式(最簡式)為_____________;
(5)要確定該物質的分子式,還要知道該物質的相對分子質量, 經測定其蒸氣密度為2.054 g·L-1(已換算為標準狀況下),則其分子式為________________;
(6)該物質的核磁共振氫譜如圖所示,則其結構簡式為__________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氟碳鈰礦(主要成分為CeFCO3)是提取稀土化合物、冶煉鈰的重要礦物原料,以氟碳鈰礦為原料提取鈰的工藝流程如圖所示。

回答下列問題:
(1)CeFCO3中Ce的化合價為___________。
(2)氧化培燒時不能使用陶瓷容器,原因是_________________。氧化焙燒后的產物之一為CeO2,則酸浸時發生反應的離子方程式為____________________。操作Ⅰ的名稱為_________。
(3)為了提高酸浸率,可以適當提高反應溫度,但溫度偏高浸出率反而會減小,其原因是_______________。
(4)已知有機物HT能將Ce3+從水溶液中萃取出來,該過程可表示為Ce3+(水層)+3HT(有機層) ![]() CeT3(有機層)+3H+(水層)。向CeT3(有機層)中加入稀硫酸能獲得較純的含Ce3+水溶液,從平衡角度解釋其原因:____________________。
CeT3(有機層)+3H+(水層)。向CeT3(有機層)中加入稀硫酸能獲得較純的含Ce3+水溶液,從平衡角度解釋其原因:____________________。
(5)298K時,向c(Ce3+)=0.02mol·L-1的溶液中加入氫氧化鈉來調節溶液的pH,若反應后溶液pH=10,此時Ce3+是否沉淀完全?__________________{列式計算,已知:Ksp[Ce(OH)3]5×l0-20,c(Ce3+)-5mol·L-1 視為沉淀完全}。
(6)寫出向Ce(OH)3懸濁液中通入氧氣得到產品Ce(OH)4的化學方程式:_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】①某NaCl樣品中可能含有SO42﹣ , CO32﹣ , 為檢驗雜質離子的存在,采取如下實驗步驟:
樣品 ![]()
![]() 無明顯現象
無明顯現象 ![]() 無明顯現象.則加入的試劑A為 , B為(填化學式),該現象證明樣品中不含有 .
無明顯現象.則加入的試劑A為 , B為(填化學式),該現象證明樣品中不含有 .
②在后續實驗中需要使用450mL0.5molL﹣1NaCl溶液,為配制該濃度NaCl溶液進行實驗,需用托盤天平稱取NaClg.
③配制NaCl溶液時,若出現下列操作,會使配制濃度偏高的是
A.稱量時NaCl已潮解
B.天平砝碼已銹蝕
C.定容時俯視刻度線
D.定容搖勻后液面下降,又加水至刻度.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com