
| △c |
| △t |
| 1mL× 0.01mol/L |
| 1mL+1mL+4mL |
| 1 |
| 6 |
| 1mL× 0.01mol/L |
| 1mL+1mL+4mL |
| 1 |
| 6 |
| ||
| 4s |
| 1 |
| 6 |
| 1 |
| 6 |


科目:高中化學 來源: 題型:閱讀理解

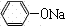 +CO2+H2O→
+CO2+H2O→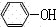 +NaHCO3
+NaHCO3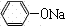 +CO2+H2O→
+CO2+H2O→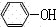 +NaHCO3
+NaHCO3
|
2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

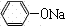 +CO2+H2O→
+CO2+H2O→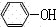 +NaHCO3;
+NaHCO3;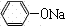 +CO2+H2O→
+CO2+H2O→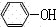 +NaHCO3;
+NaHCO3;| 實驗操作 | 預期現象 | 現象解釋 |
| 步驟1:取少量C放入a試管,加入少量蒸餾水,震蕩. | 出現白色渾濁 出現白色渾濁 |
苯酚常溫下溶解度不大 苯酚常溫下溶解度不大 |
| 步驟2:取少量C的稀溶液分裝b、c兩只試管,往b試管 滴入過量飽和溴水,振蕩. 滴入過量飽和溴水,振蕩. |
產生白色沉淀 | 苯酚與溴發生取代反應,生成三溴苯酚白色沉淀. 苯酚與溴發生取代反應,生成三溴苯酚白色沉淀. |
| 步驟3:往c試管 滴入幾滴FeCl3溶液,振蕩 滴入幾滴FeCl3溶液,振蕩 |
溶液變為紫色 溶液變為紫色 |
C與加入的試劑發生顯色反應. |
| 1 |
| 3 |
| 1 |
| 2 |
| 1000mL |
| 25.00mL |
| 1 |
| 3 |
| 1 |
| 2 |
| 1000mL |
| 25.00mL |
- 3 |
2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
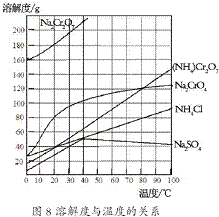 (2012?江蘇一模)重鉻酸銨[(NH4)2Cr2O7]是一種桔黃色結晶,可用作有機合成催化劑、實驗室制純凈的N2及Cr2O3等.實驗室可由工業級鉻酸鈉(Na2CrO4)為原料制取.有關物質溶解度如圖所示.實驗步驟如下:
(2012?江蘇一模)重鉻酸銨[(NH4)2Cr2O7]是一種桔黃色結晶,可用作有機合成催化劑、實驗室制純凈的N2及Cr2O3等.實驗室可由工業級鉻酸鈉(Na2CrO4)為原料制取.有關物質溶解度如圖所示.實驗步驟如下:2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
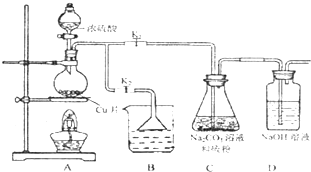 硫代硫酸鈉(Na2S2O3)可由亞硫酸鈉和硫粉通過化合反應制得.
硫代硫酸鈉(Na2S2O3)可由亞硫酸鈉和硫粉通過化合反應制得.2- 4 |
2- 7 |
| 編號 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3標準溶液的體積/mL | 18.02 | 17.98 | 18.00 | 20.03 |
2- 7 |
2- 3 |
2- 6 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com