氨與硝酸在工農業生產中均有重要的用途.某小組根據工業生產原理設計了生產氨與硝酸的主要過程如下:
(1)以N
2和H
2為原料合成氨氣.反應N
2(g)+3H
2(g)?2NH
3(g)△H<0
①一定溫度下,在密閉容器中充入1mol N
2和3mol H
2發生反應.若容器容積恒定,達到平衡狀態時,氣體的總物質的量是原來的
,則N
2的轉化率α=
;若此時放出熱量為a KJ,則其熱化學方程式為
.
②氨氣溶于水則為氨水.已知NH
3?H
2O的電離平衡常數為K
b,計算0.1mol/L的NH
3?H
2O溶液中c(OH
-)=
mol/L(設平衡時NH
3?H
2O的濃度約為0.1mol/L,用含有Kb的代數式表示).
(2)以氨氣、空氣為主要原料先進行氨的催化氧化,然后制得硝酸.
①其中NO在容積恒定的密閉容器中進行反應:2NO(g)+O
2(g)?2NO
2(g)△H>0
該反應的反應速率(v)隨時間(t)變化的關系如圖甲所示.若t
2、t
4時刻只改變一個條件,下列說法正確的是(填選項序號)
.
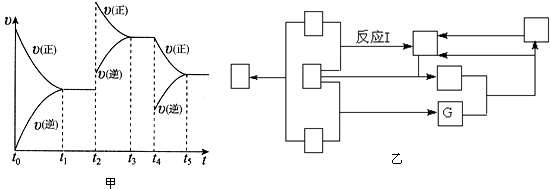
a.在t
1~t
2時,可依據容器內氣體的密度保持不變判斷反應已達到平衡狀態
b.在t
2時,采取的措施可以是升高溫度
c.在t
3~t
4時與在t
1~t
2時的平衡常數K肯定相同
d.在t
5時,容器內NO
2的體積分數是整個過程中的最大值
②實際上,生成的NO
2會聚合生成N
2O
4.如果在一密閉容器中,17℃、1.01×10
5Pa條件下,2NO
2(g)?N
2O
4(g)△H<0的平衡常數K=13.3.若改變上述體系的某個條件,達到新的平衡后,測得混合氣體中c(NO
2)=0.04mol/L,c(N
2O
4)=0.007mol/L,則改變的條件是
.
③硝酸廠常用如下方法處理尾氣用Na
2CO
3溶液吸收NO
2生成CO
2.若每9.2g NO
2和Na
2CO
3溶液反應時轉移電子數為0.1mol,則反應的離子方程式是
.
(3)圖乙表示的反應中涉及到了工業生產氨與硝酸的全部物質,每個□表示一種不同的物質,其中G為水.反應I的化學方程式是
.




 Happy holiday歡樂假期暑假作業廣東人民出版社系列答案
Happy holiday歡樂假期暑假作業廣東人民出版社系列答案 快樂暑假暑假能力自測中西書局系列答案
快樂暑假暑假能力自測中西書局系列答案