
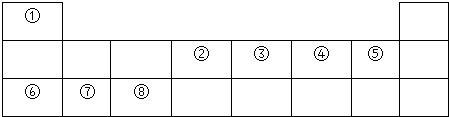
 .
. .
. ,其晶體類型屬于分子晶體,④與⑥形成的原子個數比為1:1的化合物的電子式是
,其晶體類型屬于分子晶體,④與⑥形成的原子個數比為1:1的化合物的電子式是 ,其晶體類型屬于離子晶體.
,其晶體類型屬于離子晶體.分析 由元素在周期表的位置可知,①~⑧分別為H、C、N、O、F、Na、Mg、Al,
(1)金屬性最強的元素為Na;
(2)元素⑧為Al,原子結構中有3個電子層,各層電子數分別為2、8、3;
(3)⑤與⑦形成的常見化合物為MgF2,只含離子鍵;
(4)②與④形成的三原子分子為CO2;④與⑥形成的原子個數比為1:1的化合物為Na2O2;
(5)電子層越多,原子半徑越大;同周期從左向右原子半徑減小.
解答 解:由元素在周期表的位置可知,①~⑧分別為H、C、N、O、F、Na、Mg、Al,
(1)金屬性最強的元素為Na,位于周期表中第三周期IA族,故答案為:三;IA;
(2)元素⑧為Al,原子結構中有3個電子層,各層電子數分別為2、8、3,則Al的原子結構示意圖為 ,故答案為:
,故答案為: ;
;
(3)⑤與⑦形成的常見化合物為MgF2,只含離子鍵,電子式表示該化合物的形成過程為 ,
,
故答案為:離子鍵; ;
;
(4)②與④形成的三原子分子為CO2,電子式為 ,由分子構成,屬于分子晶體;④與⑥形成的原子個數比為1:1的化合物為Na2O2,電子式為
,由分子構成,屬于分子晶體;④與⑥形成的原子個數比為1:1的化合物為Na2O2,電子式為 ,含離子鍵、共價鍵,屬于離子晶體,
,含離子鍵、共價鍵,屬于離子晶體,
故答案為: ;分子晶體;
;分子晶體; ;離子晶體;
;離子晶體;
(5)電子層越多,原子半徑越大;同周期從左向右原子半徑減小,則①、②、③、⑥、⑦中,原子半徑由大到小的順序是⑥>⑦>②>③>①,
故答案為:⑥>⑦>②>③>①.
點評 本題考查位置、結構與性質,為高頻考點,把握元素的位置、元素化合物知識、元素周期律為解答的關鍵,側重分析與應用能力的考查,注意化學用語及規律性知識的使用,題目難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 氧化性:MnO4-<Cl2<Fe3+<I2 | |
| B. | 還原性:Fe2+>I->Cl- | |
| C. | FeCl3能使濕潤的淀粉碘化鉀試紙變藍 | |
| D. | 反應①中只體現鹽酸的還原性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 200mL0.1mol/LKCl溶液 | B. | 200mL0.10mol/LNaCl溶液 | ||
| C. | 200 mL 0.10mol/LBaCl2溶液 | D. | 100mL0.1mol/LAl2(SO4)3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
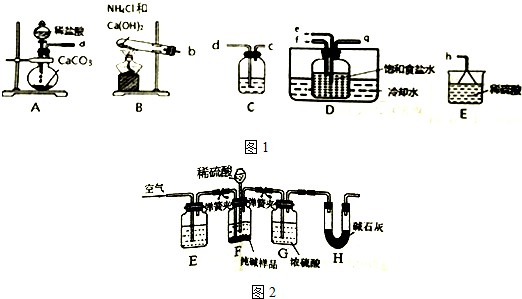
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
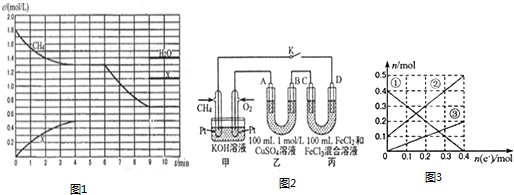
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
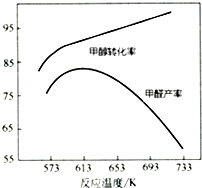 Ⅰ.工業上主要以甲醇為原料進行制備甲醛(HCHO).
Ⅰ.工業上主要以甲醇為原料進行制備甲醛(HCHO).| 物質 | 反應熱/kJ•mol-1 |
| CH3OH (g) | -726.5 |
| HCHO (g) | -570.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
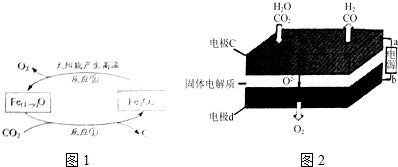
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
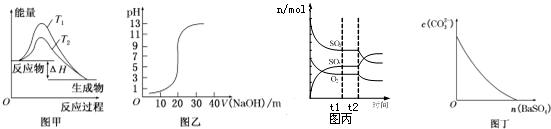
| A. | 圖甲表示溫度T1>T2,SO2與O2反應過程中的能量變化 | |
| B. | 圖乙表示0.100 0 mol/L NaOH溶液滴定20.00ml 0.100 0 mol/L CH3COOH溶液所得到的滴定曲線 | |
| C. | 圖丙表示一定條件下進行的反應2SO2+O2?2SO3各成分的物質的量變化,t2時刻改變的條件可能是縮小容器體積 | |
| D. | 圖丁表示在飽和Na2CO3溶液中逐步加BaSO4固體后,溶液中c(CO32-)濃度變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com