
【題目】(CH3CH2)2CHCH3的正確命名是( )
A.2-乙基丁烷B.2-甲基戊烷C.3-乙基丁烷D.3-甲基戊烷
科目:高中化學 來源: 題型:
【題目】現有由等質量的NaHCO3和KHCO3組成的混合物a g,與100mL鹽酸反應。(題中涉及的氣體體積均以標準狀況計,填空時可以用帶字母的式子表示。)
(1)該混合物中NaHCO3與KHCO3的物質的量之比為__________________;
(2)如碳酸氫鹽與鹽酸恰好完全反應,則鹽酸中HCl的物質的量為_____________mol;
(3)如果鹽酸過量,生成CO2的體積為______________L;
(4)如果反應后碳酸氫鹽有剩余,鹽酸不足量,要計算生成CO2的體積,還需要知道_______________;
(5)若NaHCO3和KHCO3不是以等質量混合,則a g固體混合物與足量的鹽酸完全反應時生成CO2的體積[V(CO2)]范圍是________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“蘇丹紅一號”(結構如下圖所示)是一種合成染料,科學家通過經毒理學研究,發現長期食用含有蘇丹紅的食品對人體可能有致癌因素。下列關于“蘇丹紅一號”的說法中不正確的是

A. 屬于芳香族化合物,分子式為C16H12N2O
B. 分子中的所有原子可能位于同一平面上
C. 分子中苯環上的一取代物共有11種
D. 能與NaOH溶液、FeCl3溶液、溴水等物質反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業碳酸鈉(純度約為98%)中含有Mg2+、Fe2+、Cl-和SO42-等雜質,提純工藝流程如下,下列說法不正確的是
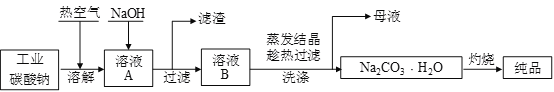
A. 步驟①,通入熱空氣可以將Fe2+氧化
B. 步驟②,產生濾渣的主要成分為Mg(OH)2和 Fe(OH)3
C. 步驟③,趁熱過濾時溫度控制不當會使Na2CO3·H2O中混有Na2CO3·10H2O等雜質
D. 步驟④,灼燒Na2CO3·H2O在瓷坩堝中進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼、鎂及其化合物在工農業生產中應用廣泛。
已知:硼鎂礦主要成分為Mg2B2O5H2O,硼砂的化學式為Na2B4O710H2O。利用硼鎂礦制取金屬鎂及粗硼的工藝流程為:
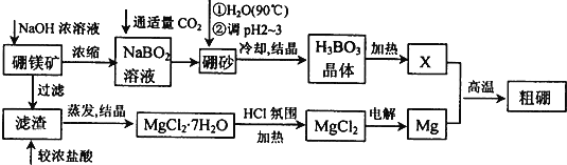
回答下列有關問題:
(1)硼砂中B的化合價為________________,溶于熱水后,常用H2SO4調pH為2~3制取H3BO3,反應的離子方程式為________________________________________________________________。X為H3BO3晶體加熱脫水的產物,其與Mg制取粗硼的化學方程式為_______________________________________________________________。
(2)MgCl2·7H2O需要在HCl氛圍中加熱,其目的是______________________________________________________________。若用惰性電極電解MgCl2溶液,其總反應離子方程式為____________________________________________________________。
(3)鎂-H2O2酸性燃料電池的反應機理為Mg+H2O2+2H+═Mg2++2H2O,則正極反應式為____________________________________________________。
(4)制得的粗硼在一定條件下生成BI3,BI3加熱分解可以得到純凈的單質硼。現將0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定至終點,并選用指示劑,達到滴定終點的現象是_________________________________________。消耗Na2S2O3溶液18.00mL。該粗硼樣品的純度為__________________。(提示:I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨基甲酸銨(H2NCOONH4)是一種易分解、易水解的白色固體,可用于化肥、滅火劑、洗滌劑等。某研究小組用下圖所示的實驗裝置,利用氫氧化鈉固體、濃氨水、干冰等作原料制備氨基甲酸銨。主要反應原理:2NH3(g) + CO2(g)=H2NCOONH4(s) ΔH<0。
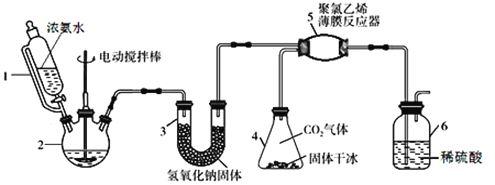
(1)實驗室用98%的濃硫酸配制15%的稀硫酸,除量筒外還需使用下列儀器中的____。
a.燒杯 b.一定容積的容量瓶 c.玻璃棒 d.滴定管
(2)儀器1恒壓分液漏斗,其優點是__________________________。
(3)儀器3中NaOH固體的作用是__________________________。
(4)儀器6的一個作用是控制原料氣按反應計量系數充分反應,若反應初期觀察到裝置內稀硫酸溶液中產生氣泡,應該______(填“加快”、“減慢”或“不改變”)產生氨氣的流速。
(5)另有一種制備氨基甲酸銨的反應器(CCl4與液體石蠟均為惰性介質)如圖。生成的氨基甲酸銨小晶體懸浮在四氯化碳中,當懸浮物較多時,停止制備。
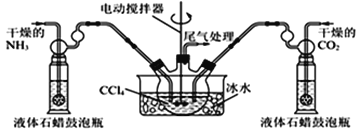
①發生器用冰水冷卻的原因是________________________________________;
②從反應后混合物中過濾分離出產品。為了得到干燥產品,應采取的方法是_____(填序號)
a.常壓加熱烘干 b.高壓加熱烘干 c.真空40℃以下烘干
(6)已知氨基甲酸銨可完全水解,其中產物有碳酸氫銨。氨基甲酸銨水解反應的化學方程式為________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在溫度和容積不變的條件下進行。能表明反應達到平衡狀態的敘述是( )
Fe3O4(s)+4H2(g)在溫度和容積不變的條件下進行。能表明反應達到平衡狀態的敘述是( )
A. 容器內的總壓強不隨時間變化
B. 斷裂4molH—O鍵的同時,斷裂2molH—H鍵
C. 混合氣體分子的總數不變
D. 反應不再進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:轉化率=某一反應物轉化的量÷該反應物的初始量×100%。在一密閉容器中加入A、B、C三種氣體,保持溫度一定,在t1~t4時刻測得各物質的濃度如下表。據此判斷下列結論不正確的是
測定時刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
A. 在t4時刻,該反應處于化學平衡狀態
B. t3時,A的轉化率比B的轉化率高
C. t1至t2時刻,該反應的速率為3 mol·L-1 s-1
D. 該反應的化學方程式是:2A(g)+B(g)![]() C(g)
C(g)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應Fe(s) +CO2 (g)![]() FeO(s)+CO(g),700℃時平衡常數為1.47,900℃時平衡常數為2.15。下列說法正確的是( )
FeO(s)+CO(g),700℃時平衡常數為1.47,900℃時平衡常數為2.15。下列說法正確的是( )
A. 升高溫度該反應的正反應速率增大,逆反應速率減小
B. 該反應的化學平衡常數表達式為K=c(FeO)c(CO)/c(Fe)c(CO2)
C. 絕熱容器中進行該反應,溫度不再變化,則達到化學平衡狀態
D. 該反應的正反應是放熱反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com