
| A. | NH3 | B. | O3 | C. | CO2 | D. | BeCl2 |
分析 中心原子的雜化類型為sp3,說明該分子中心原子的價層電子對個數是4,價層電子對個數=σ鍵個數+孤電子對個數,σ鍵個數=配原子個數,孤電子對個數=$\frac{1}{2}$×(a-xb),a指中心原子價電子個數,x指配原子個數,b指配原子形成穩定結構需要的電子個數,據此判斷.
解答 解:A.NH3分子中氮原子價層電子對個數=3+$\frac{1}{2}$×(5-3×1)=4,所以N原子采用sp3雜化,故A正確;
B.O3分子中氧原子價層電子對個數=2+$\frac{1}{2}$×(6-2×2)=3,所以O原子采用sp2雜化,故B錯誤;
C.CO2分子中碳原子價層電子對個數=2+$\frac{1}{2}$×(4-2×2)=2,所以C原子采用sp雜化,故C錯誤;
D.BeCl2中鈹原子價層電子對個數=2+$\frac{1}{2}$×(2-1×2)=2,所以Be原子采用sp雜化,故D錯誤;
故選A.
點評 本題考查了原子雜化方式的判斷,根據價層電子對互斥理論來分析解答即可,明確孤電子對個數=$\frac{1}{2}$(a-xb)中各個字母的含義,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
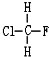 與
與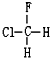 B.
B. 與
與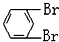 C.
C.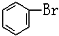 與
與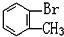 D.
D.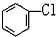 與
與 E.ClC(CH3)3與(CH3)2CHCH2Cl F.
E.ClC(CH3)3與(CH3)2CHCH2Cl F.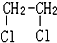 與CH3-CH2Cl
與CH3-CH2Cl 由一種單體脫水縮聚而成的,該單體的鍵線式為
由一種單體脫水縮聚而成的,該單體的鍵線式為
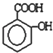 )滴入Na2CO3溶液中,生成的有機物的結構簡式是:
)滴入Na2CO3溶液中,生成的有機物的結構簡式是: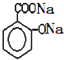
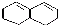 在較高溫度下和Br2按物質的量之比1:1發生1,4-加成反應的化學方程式
在較高溫度下和Br2按物質的量之比1:1發生1,4-加成反應的化學方程式 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 研究化學反應中的能量變化,有利于通過改變反應條件,使同一反應消耗相同量的物質而放出更多的熱,提高化學能的利用率 | |
| B. | 任何放熱的化學反應,均可以利用原電池直接把化學能轉化為電能 | |
| C. | 研究化學反應速率與化學平衡,有利于指導實際生產中達到“多,快,好,省”的生產效率 | |
| D. | 使用催化劑常常可以加快化學反應速率,但不能提高反應物的轉化率,因此在實際生產中較少使用催化劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸、純堿、氯酸鉀、氧化鈉分別屬于酸、堿、鹽、堿性氧化物 | |
| B. | 將飽和FeCl3溶液滴入NaOH溶液中,加熱煮沸,可制得Fe(OH)3膠體 | |
| C. | 反應8NH3+3Cl2═N2+6NH4Cl中,氧化劑與還原劑物質的量之比是3:2 | |
| D. | 氯氣的水溶液能導電,因此氯氣屬于電解質 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com