
分析 (1)依據配制溶液體積選擇合適的容量瓶,依據m=cvM計算需要溶質的質量;
(2)配制一定物質的量濃度溶液一般步驟:計算、稱量、溶解、冷卻、移液、洗滌、定容、搖勻等操作,據此排序;
(3)分析操作對溶質的物質的量和溶液體積的影響,依據C=$\frac{n}{V}$進行誤差分析;
(4)依據n=CV計算碳酸鈉、硫酸的物質的量,依據Na2CO3~H2SO4~CO2計算生成二氧化碳物質的量;依據1mol碳酸鈉含有2mol鈉離子計算鈉離子的物質的量,依據C=$\frac{n}{V}$計算鈉離子的物質的量濃度.
解答 解:(1)要配制溶液的體積為240ml,只能選用250ml的容量瓶,Na2CO3的物質的量n=cV=0.25×0.2=0.05mol,則Na2CO3•10H2O的質量=0.05×286=14.3g;
故答案為;14.3;
(2)配制步驟有計算、稱量、溶解、冷卻、移液、洗滌、定容、搖勻等操作,則正確的操作順序是BCAFED;
故答案為:BCAFED;
(3)A.所選用的溶質已經變質,部分已失去了結晶水,則溶質的質量偏大,溶液濃度偏高,A正確;
B.轉移前,容量瓶中含有少量蒸餾水,對溶質的物質的量和溶液的體積都不產生影響,對結果無影響,故B錯誤;
C.將未冷卻的溶液沿玻璃棒注入容量瓶中,導致定容時加水的體積偏小,濃度偏高,故C正確;
D.定容時,仰視刻度線,溶液的體積偏大,濃度偏低,故D錯誤;
E.稱量時誤操作為“左碼右物”,則溶質質量偏小,溶質的物質的量偏小,濃度偏低,故E錯誤;
F.定容后使溶液混勻靜止,發(fā)現凹液面低于刻度線,立即滴蒸餾水至刻度線,導致體積偏大,濃度偏低,故F錯誤;
故選:AC;
(4)125mL0.2mol/LNa2CO3的物質的量為0.125L×0.2mol/L=0.025mol,125mL 0.3mol/L的硫酸的物質的量為0.125L×0.3mol/L=0.0375mol,則硫酸過量,碳酸鈉完全反應生成二氧化碳,則生成二氧化碳0.025mol,標準狀況下體積為0.025mol×22.4L/mol=0.56L=560mL,反應后溶液中鈉離子物質的量為0.025mol×2=0.05mol,則鈉離子的物質的量濃度=$\frac{0.05mol}{0.25L}$=0.2mol/L;
故答案為:560; 0.2mol/L.
點評 本題考查了一定物質的量濃度溶液的配制,明確配制原理及操作步驟是解題關鍵,側重考查學生實驗能力和分析能力,注意誤差分析的方法.


科目:高中化學 來源: 題型:選擇題
| A. | Na2FeO4在凈水過程中能轉變成氫氧化鐵 | |
| B. | Na2FeO4能殺菌消毒 | |
| C. | Na2FeO4能除去水中的硫化氫等還原性氣體雜質 | |
| D. | Na2FeO4能吸附水中的顏色和固體顆粒 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
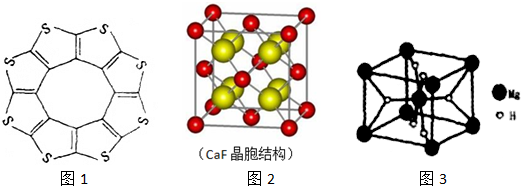
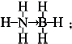 ;與氨硼烷互為等電子體的有機小分子是CH3CH3(寫結構簡式).
;與氨硼烷互為等電子體的有機小分子是CH3CH3(寫結構簡式).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
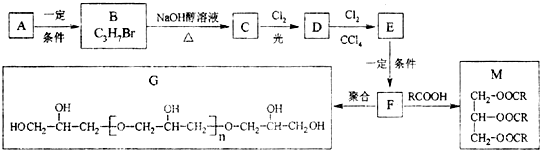
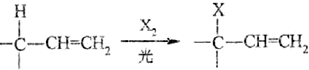
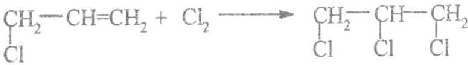 .
.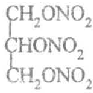 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉溶于水的反應:2Na+2H2O═2NaOH+H2↑ | |
| B. | 碳酸鈉溶液和稀醋酸反應:CO2-3+2H+═H2O+CO2↑ | |
| C. | 向Ba(OH)2溶液中逐滴加入硫酸氫鈉溶液至中性:2H++SO2-4+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 硫化亞鐵中加入稀硝酸:FeS+2H+═Fe2++H2S↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
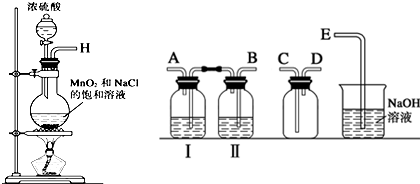
| 實驗步驟 | 預期現象與結論 | |
| 步驟1 | 取少量上述漂白粉于試管中,先加入適量1mol•L-1鹽酸溶解后,再把生成的氣體通入新制澄清石灰水中. | 若澄清石灰水未見渾濁,則假設1成立; 若澄清石灰水變渾濁,則假設2或假設3成立. |
| 步驟2 | 已確定漂白粉變質,則另取少量上述漂白粉于試管中,先加入適量1mol•L-1 HCl溶液,再加入幾滴品紅溶液振蕩. | 若品紅溶液不褪色,則假設2成立; 若品紅溶液褪色,則假設3成立. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等物質的量的硫蒸氣和硫固體分別完全燃燒,后者放出的熱量多 | |
| B. | 由單質A轉化為單質B△H=+119kJ/mol,可知單質B比單質A穩(wěn)定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol | |
| D. | 在25℃、101kPa時,2g H2完全燃燒生成液態(tài)水,放出285.8kJ熱量,則表示H2燃燒熱的化學方程式為2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 熱穩(wěn)定性:Y的氣態(tài)氫化物>Z的氣態(tài)氫化物 | |
| B. | Z的最高價氧化物對應水化物的分子式為H2ZO4 | |
| C. | X元素的單質能與所有強酸發(fā)生反應放出H2 | |
| D. | R的核外電子數與OH-的核外電子數相同 |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com