
【題目】環己酮(![]() )在生產生活中有重要的用途,可在酸性溶液中用環己醇間接電解氧化法制備,其原理如下圖所示。下列說法正確的是
)在生產生活中有重要的用途,可在酸性溶液中用環己醇間接電解氧化法制備,其原理如下圖所示。下列說法正確的是
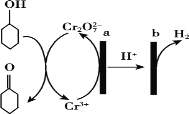
A.a極與電源負極相連
B.a極電極反應式是2Cr3++7H2O —6e-=Cr2O72-+14H+
C.b極發生氧化反應
D.理論上有1mol環己酮生成時,有2mol氫氣放出
【答案】B
【解析】
根據裝置圖可知,a極為電解池的陽極,Cr3+失電子發生氧化反應,電極反應式是2Cr3++7H2O-6e-═Cr2O72-+14H+,b極為陰極,氫離子得電子發生還原反應,結合轉移電子數相等計算,據此分析解答。
A.根據裝置圖可知,a極為電解池的陽極,則與電源正極相連,故A錯誤;
B.根據裝置圖可知,a極為電解池的陽極,Cr3+失電子發生氧化反應,電極反應式是2Cr3++7H2O-6e-═Cr2O72-+14H+,故B正確;
C.b極為陰極,氫離子得電子發生還原反應,故C錯誤;
D.理論上由環己醇(C6H12O)生成1mol環己酮(C6H10O)時,轉移2mol電子,根據電子守恒可知陰極有1mol氫氣放出,故D錯誤;
故選:B。


 寒假樂園北京教育出版社系列答案
寒假樂園北京教育出版社系列答案科目:高中化學 來源: 題型:
【題目】已知:還原性![]() ,氧化性
,氧化性![]() 在含3mol
在含3mol![]() 的溶液中逐滴加入
的溶液中逐滴加入![]() 溶液,加入
溶液,加入![]() 和析出
和析出![]() 的物質的量的關系曲線如圖所示.則下列有關說法正確的是( )
的物質的量的關系曲線如圖所示.則下列有關說法正確的是( )
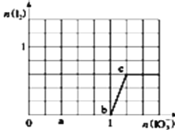
A.b點時的還原產物可能是![]()
B.當![]() 時,溶液中
時,溶液中![]()
C.a點時剩余![]() 的物質的量為
的物質的量為![]()
D.反應過程中的氧化反應所得產物均為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯在飲用水處理中常用作殺菌劑,且HClO的殺菌能力比ClO-強。25℃時氯氣-氯水體系中存在以下平衡關系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+H2O![]() HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO![]() H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分別在三者中所占分數(α)隨pH變化的關系如圖所示。下列表述正確的是( )
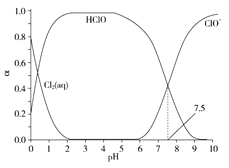
A.Cl2(g)+H2O![]() 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯處理水體系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯處理飲用水時,pH=7.5時殺菌效果比pH=6.5時差
D.氯處理飲用水時,在夏季的殺菌效果比在冬季好
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下將NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH與離子濃度變化的關系如圖所示。下列敘述錯誤的是

A. Ka2(H2X)的數量級為10-6
B. 曲線N表示pH與 的變化關系
的變化關系
C. NaHX溶液中c(H+)>c(OH-)
D. 當混合溶液呈中性時,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA代表阿伏加德羅常數的數值,下列說法正確的是
A.常溫常壓下,3.4g NH3含N—H 鍵0.2 NA
B.標準狀況下,1.4g N2、CO混合氣體體積約為1.12 L
C.常溫常壓下,100 mL 0.1mol·L—1的過氧化氫水溶液中含氫原子的數目為0.02 NA
D.常溫常壓下,0.1 mol·L-1CH3COONa溶液中,c(CH3COO—)小于0.1 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解原理在化學工業中有廣泛應用。
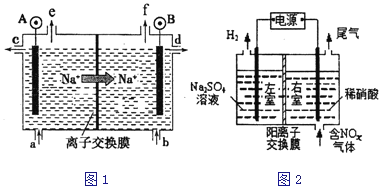
(1)電解食鹽水是氯堿工業的基礎.目前比較先進的方法是陽離子交換膜法,電解示意圖如圖1所示,圖中的陽離子交換膜只允許陽離子通過,請回答以下問題:
①電解池實現了_______能向_______能的轉化;
②圖中A極要連接電源的__________(填“正”或“負”)極;
③電解總反應的化學方程式是______________________。
(2)電解法處理含氮氧化物廢氣,可回收硝酸,具有較高的環境效益和經濟效益。實驗室模擬電解法吸收NOx的裝置如圖2所示(圖中電極均為石墨電極),若用NO2氣體進行模擬電解法吸收實驗,寫出電解時NO2發生的電極反應_______________________。
(3)在實際生產中,可在鐵件的表面上鍍銅防止鐵被腐蝕,裝置示意圖如下甲圖:
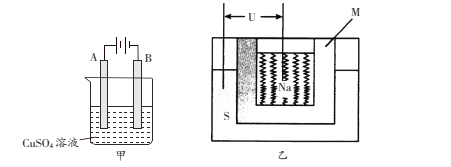
①電鍍時,鍍件與電源的____極連接,
②B電極上的電極反應是________________。
③乙圖是一種鈉硫高能電池的結構示意圖,M由Na2O和Al2O3制得,其作用是導電和隔膜,該電池反應為2Na+xS=Na2Sx。用該電池作電源進行上述鐵件鍍銅時,若電鍍池中兩電極的質量開始相同,電鍍完成后取出洗凈、烘干、稱量,二者質量差為25.6g,則理論上該電池負極消耗的質量為___________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某種降血壓藥物硝苯地平的合成路線如下:

已知:
 +R”’CHO
+R”’CHO
(1)A 的結構簡式是 ___________。
(2)B與新制Cu(OH)2 反應的化學方程式是 ______________。
(3)H → I的反應類型是 _______________。
(4)試劑a 是 _______________。
(5)J→K的化學反應方程式是 ___________。
(6)F 有多種同分異構體,寫出滿足下列條件的一種同分異構體的結構簡式__________。
①分子中含有酯基,且存在順反異構
②能與金屬Na單質反應,且能發生銀鏡反應
(7)1 mol 硝苯地平最多可與__________mol NaOH溶液發生水解反應。
(8)已知 D![]() E→F +CH3OH,E的結構簡式是_______________。
E→F +CH3OH,E的結構簡式是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】珍愛生命,遠離毒品.以下是四種毒品的結構簡式,下列有關說法正確的是

A.四種毒品中都含有苯環,都屬于芳香烴
B.K粉的化學式為C13H15ONCl
C.搖頭丸經過消去反應、加成反應可制取冰毒
D.1mol大麻與溴水反應最多消耗4molBr2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室合成乙酸乙酯的步驟如下:在圓底燒瓶內加入乙醇、濃硫酸和乙酸,瓶口豎直安裝通有冷卻水的冷凝管(使反應混合物的蒸氣冷凝為液體流回燒瓶內),加熱回流一段時間后換成蒸餾裝置進行蒸餾(如下圖所示),得到含有乙醇、乙酸和水的乙酸乙酯粗產品。請回答下列問題:
(已知:乙醇、乙酸、乙酸乙酯的沸點依次是78.4℃、118℃、77.1℃)

(1)在燒瓶中除了加入乙醇、濃硫酸和乙酸外,還應放入_____,其目的是________________________。
(2)在燒瓶中加入一定比例的乙醇和濃硫酸的混合液的方法是:______________________。
(3)在該實驗中,若用1 mol乙醇和1 mol乙酸在濃硫酸作用下加熱,充分反應,能否生成1 mol乙酸乙酯,為什么?__________________________________________。
(4)現擬分離含乙酸、乙醇和水的乙酸乙酯粗產品,下圖是分離操作步驟流程圖。請在圖中圓括號內填入適當的試劑,在方括號內填入適當的分離方法。
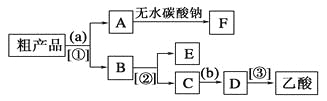
試劑a是__________,試劑b是__________;分離方法①是________,分離方法②是________,分離方法③是______。
(5)在得到的A中加入無水碳酸鈉粉末,振蕩,目的是________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com